
下图的各方框表示有关的一种反应物或生成物(某些
物质已经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝。
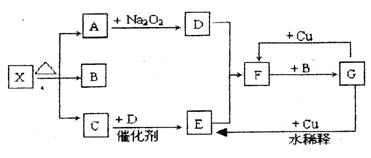
 (1)写出下列各物质的化学式:
(1)写出下列各物质的化学式:
X: ;B: ;F:  ;G: 。
;G: 。
(2)写出下列变化的反应方程式:
A→D: ; G→E: 。
(3)实验室里,常用加热 的混合物的方法 制取气体C,常采用 法来收集,可否用无水CaCl2干燥气体C (填“否”或者“可以”)。
制取气体C,常采用 法来收集,可否用无水CaCl2干燥气体C (填“否”或者“可以”)。
科目:高中化学 来源: 题型:
某学生用优质大理石与稀盐酸反应制取CO2,实验结果如下图所示,对于图中曲线的叙述正确的是( )

|
| A. | AB段表示反应速率最快 |
|
| B. | BC段表示反应速率最快,在该时间内收集到的气体最多 |
|
| C. | OC段表示随时间增加,反应速率逐渐增大 |
|
| D. | OC段表示反应产物中气体体积随时间的变化关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列电离方程式正确的是
A.NaHCO3= Na++ H++CO32- B.Ba(OH)2=Ba2++OH-
C.Al2(SO4)3=2Al3++3SO42- D.H2SO4=H2++SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,下列叙述正确的是
( )
A.含有NA个氦原子的氦气在标准状况下的体积约为11.2L
B.25℃,1.01×105 Pa, 32 g O2和O3的混合气体所含原子数为2NA
C.标准状况下,11.2LH2O 含有的分子数为0.5NA
D.在常温常压下,44gCO2含有的分子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列反应的化学方程式,判断有关物质的还原性强
弱顺序是( )
①I2 + SO2 + 2H2O = H2SO4 + 2HI; ② 2FeCl2 + Cl2 = 2FeCl3;
③2 FeCl3 + 2HI = 2FeCl2 + 2HCl+I2
FeCl3 + 2HI = 2FeCl2 + 2HCl+I2
A.SO2>I->Fe2+>Cl- B.Cl->Fe2+>SO2>I-
C.Fe2+>I->Cl->SO2 D.I->Fe2+>Cl->SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列做法会对人体健康造成较大危害的是( )
A.用大量SO2漂白银耳
B.用小苏打(NaHCO3)焙制糕点
C.用食醋清洗热水瓶胆内壁附着 的水垢(CaCO3)
的水垢(CaCO3)
D.用消毒液(有效成分NaClO)对餐具进行杀菌消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法 正确的是( )
正确的是( )
A.摩尔质量就等于物质的相对 分子质量
分子质量
B.摩尔质量就是物质相对分子质量的6.02×1023倍
C.HNO3的摩尔质量是63g
D.硫酸和磷酸的摩尔质量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于金属及金属键的说法正确的是( )
|
| A. | 金属键具有方向性和饱和性 |
|
| B. | 金属键是金属阳离子与自由电子间的相互作用 |
|
| C. | 金属导电是因为在外加电场作用下产生自由电子 |
|
| D. | 金属具有光泽是因为金属阳离子吸收并放出可见光 |
查看答案和解析>>
科目:高中化学 来源: 题型:
、TiO2可通过下述两种方法制备金属钛:
方法一:电解TiO2来获得Ti,将处理过的TiO2作阴极,石墨为阳极,熔融CaO为电解液,用石墨作电解槽池.
(1)阳极的电极反应式为 .
(2)电解过程中需定期更换石墨电极的原因是 .
方法二:先将TiO2与Cl2、C反应得到TiCl4,再用镁还原得到Ti.
(3)TiO2(s)+2Cl2(g)⇌TiCl4(l)+O2(g)△H=+151kJ•mol﹣1该反应难以发生,原因是 .
不能直接由TiO2 和Cl2反应(即氯化反应)来制取TiCl4,当往氯化反应体系中加入碳后,碳与上述反应发生耦合,使反应在高温条件下能顺利进行.
(4)已知:C(s)+O2(g)=CO2(g)△H=﹣394kJ•mol﹣1
TiO2(s)+C(s)+2Cl2(g)=TiCl4(l)+CO2(g)△H=
(5)从化学平衡的角度解释:往氯化反应体系中加入碳时,氯化反应能顺利进行的原因 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com