
| A. | 某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为CnH2n | |
| B. | 相同物质的量的烃,完全燃烧,生成的CO2越多,说明烃中C的百分含量越高 | |
| C. | 某气态烃CxHy与足量O2恰好完全反应,如果反应前后气体体积不变(温度>100℃),则y=4;若体积减少,则y>4 | |
| D. | 相同质量的烃,完全燃烧,消耗O2越多,烃中H的百分含量越高 |
分析 A.不能确定该有机物是否含有O元素;
B.相同物质的量的烃,完全燃烧,生成的CO2越多,说明烃分子中碳原子数目大,但碳元素的含量不一定大;
C.燃烧通式为:CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O,利用体积差量法计算判断;
D.由关系式C~O2~CO2、4H~O2~2H2O,判断相同质量C、H消耗氧气多少.
解答 解:A.不能确定该有机物是否含有O元素,生成CO2和H2O,二者物质的量相等,此有机物的组成为CnH2nOx,故A错误;
B.相同物质的量的烃,完全燃烧,生成的CO2越多,说明烃分子中碳原子数目大,但碳元素的含量不一定大,如乙烯和丙烯,故B错误;
C.燃烧通式为:CxHy+(x+$\frac{y}{4}$)O2 $\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O,如果反应前后气体体积不变(温度>100℃),则1+(x+$\frac{y}{4}$)=x+$\frac{y}{2}$,解得y=4;若体积减小,1+(x+$\frac{y}{4}$)>x+$\frac{y}{2}$,则y<4;反之,1+(x+$\frac{y}{4}$)<x+$\frac{y}{2}$,则y>4,故C错误;
D.由关系式C~O2~CO2、4H~O2~2H2O,可知消耗32g氧气需要C元素12g、需要H元素4g,即相同质量C元素、H元素中H元素消耗氧气更多,即相同质量的烃,完全燃烧,消耗O2越多,烃中的氢元素的含量越高,故D正确,
故选D.
点评 本题考查有机物燃烧有关计算,难度不大,侧重考查学生分析计算能力,注意对有机物燃烧规律的理解掌握.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验①说明Na2S2O3溶液中水电离的c(OH-)=10-8mol/L | |
| B. | Na2S2O3溶液PH=8的原因用离子方程式表示为S2O32-+2H2O═H2S2O3+2OH- | |
| C. | 生成的沉淀BaSO3或BaSO4,要进一步确认还需再加入稀硝酸验证 | |
| D. | 实验②说明Na2S2O3具有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4NO3→N2+O2+H2O | B. | NH4NO3→NH3+HNO3 | ||
| C. | NH4NO3→O2+HNO3+H2O | D. | NH4NO3→N2+HNO3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 缩小体积使压强增大 | B. | 恒容,充入N2 | ||
| C. | 恒容充入氦气 | D. | 恒压充入氦气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 1:1 | C. | 3:2 | D. | 4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0-10min的平均反应速率:n(ClNO)=7.5×10-3mol•L-1•min-1 | |
| B. | 平衡时NO的转化率为75% | |
| C. | 其它条件保持不变,反应若在恒压条件下进行,平衡时NO的转化率变大 | |
| D. | 升高温度,反应的平衡常数减小,则△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
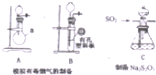 某化工厂排放了大量有毒气体,其主要成分是SO2、CO2、N2和O2,某研究性学习小组在实验室利用右图装置制备模拟有毒烟气,同时利用模拟有毒烟气中的SO2制取硫代硫酸钠晶体(Na2S2O3•5H2O),并进一步实验测定该晶体的纯度.查阅资料得知:①将SO2通入按一定比例配制成的Na2S和Na2CO3的混合溶液中,可制得Na2S2O3•5H2O;②KI3溶液为碘单质的碘化钾溶液;③硫代硫酸钠(Na2S2O3)具有较强的还原性,回答下列问题:
某化工厂排放了大量有毒气体,其主要成分是SO2、CO2、N2和O2,某研究性学习小组在实验室利用右图装置制备模拟有毒烟气,同时利用模拟有毒烟气中的SO2制取硫代硫酸钠晶体(Na2S2O3•5H2O),并进一步实验测定该晶体的纯度.查阅资料得知:①将SO2通入按一定比例配制成的Na2S和Na2CO3的混合溶液中,可制得Na2S2O3•5H2O;②KI3溶液为碘单质的碘化钾溶液;③硫代硫酸钠(Na2S2O3)具有较强的还原性,回答下列问题:| 编号 | 1 | 2 | 3 |
| 消耗KI3溶液的体积/mL | 19.99 | 23.00 | 20.01 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com