
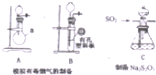
 某化工厂排放了大量有毒气体,其主要成分是SO2、CO2、N2和O2,某研究性学习小组在实验室利用右图装置制备模拟有毒烟气,同时利用模拟有毒烟气中的SO2制取硫代硫酸钠晶体(Na2S2O3•5H2O),并进一步实验测定该晶体的纯度.查阅资料得知:①将SO2通入按一定比例配制成的Na2S和Na2CO3的混合溶液中,可制得Na2S2O3•5H2O;②KI3溶液为碘单质的碘化钾溶液;③硫代硫酸钠(Na2S2O3)具有较强的还原性,回答下列问题:
某化工厂排放了大量有毒气体,其主要成分是SO2、CO2、N2和O2,某研究性学习小组在实验室利用右图装置制备模拟有毒烟气,同时利用模拟有毒烟气中的SO2制取硫代硫酸钠晶体(Na2S2O3•5H2O),并进一步实验测定该晶体的纯度.查阅资料得知:①将SO2通入按一定比例配制成的Na2S和Na2CO3的混合溶液中,可制得Na2S2O3•5H2O;②KI3溶液为碘单质的碘化钾溶液;③硫代硫酸钠(Na2S2O3)具有较强的还原性,回答下列问题:| 编号 | 1 | 2 | 3 |
| 消耗KI3溶液的体积/mL | 19.99 | 23.00 | 20.01 |
分析 (1)仪器a的名称是圆底烧瓶;
(2)制取二氧化碳采取固液不加热装置,通过长颈漏斗控制加如盐酸的量,从而控制盐酸和塑料板上碳酸钙的接触面积,随时控制反应的发生和停止;
(4)依据所给的反应物和生成物书写离子反应方程式即可;
(5)达到滴定终点时颜色突变且30s不变色;先根据滴定消耗的标准液的体积计算出平均体积,再由2S2O32-+I3-→S4O62-+3I-,的定量关系计算即可.
解答 解:(1)仪器a的名称是圆底烧瓶,故答案为:圆底烧瓶;
(2)制取二氧化碳采取固液不加热装置,为了做到随关随停,易选择B装置,即通过控制长颈漏斗盐酸的加入量,控制反应的发生和停止,实验室采取大理石与稀盐酸制取二氧化碳气体,反应的离子反应方程式为:CaCO3+2H+=Ca2++CO2↑+H2O,故答案为:B;CaCO3+2H+=Ca2++CO2↑+H2O;随时控制反应的发生和停止;
(4)根据氧化剂与还原剂得失电子数目相等,则有Na2S~2SO2,结合元素质量守恒,可写出化学方程式为2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2,
故答案为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2;
(5)达到滴定终点时,溶液由无色变为蓝色且半分钟内不再变化,由于第2次实验数据误差较大,故舍去,剩余2次消耗的KI3溶液的体积平均值为20.00mL,
2S2O32-+I3-→S4O62-+3I-
2 1
n 0.1000mol/L×0.020L
n=0.004mol,500ml溶液中含有S2O32-物质的量为0.004mol×$\frac{500}{20}$=0.1mol,
Na2S2O3•5H2O(式量248)的质量分数是=$\frac{0.1mol×248g/mol}{32.0g}$×100%=77.5%,
故答案为:溶液由无色变为蓝色,半分钟内不再变化;77.5%.
点评 本题以某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O)为载体,考查了物质的分离提纯、检验、设计优化等,综合性较强.


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为CnH2n | |
| B. | 相同物质的量的烃,完全燃烧,生成的CO2越多,说明烃中C的百分含量越高 | |
| C. | 某气态烃CxHy与足量O2恰好完全反应,如果反应前后气体体积不变(温度>100℃),则y=4;若体积减少,则y>4 | |
| D. | 相同质量的烃,完全燃烧,消耗O2越多,烃中H的百分含量越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以上反应均可发生 | B. | 只有①不能发生 | ||
| C. | 只有⑥不能发生 | D. | 只有②不能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| 沉淀完全的pH | 3.0 | 8.8 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式可能为C3H6O2 | |
| B. | 该物质不存在属于酯类的同分异构体 | |
| C. | 相对分子质量比乙酸大14n(n为整数) | |
| D. | 完全燃烧时生成CO2和H2O的质量比一定为11:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Cl2能与金属活动顺序表中大多数金属反应 | |
| B. | 待测溶液中加入氯化钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,一定有硫酸根离子 | |
| C. | 在用AgNO3溶液检验Cl-时,一般先在被检测的溶液中滴入少量的稀硝酸使其酸化,以排除干扰离子 | |
| D. | 硅是应用广泛的半导体材料,常温下化学性质不活泼,是光导纤维的主要成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化氮中混有一氧化氮杂质,可通入氧气将一氧化氮转化为二氧化氮 | |
| B. | 过量的铜与浓硝酸反应一定有一氧化氮生成 | |
| C. | Fe与S混合加热生成FeS2 | |
| D. | 工业上利用氨气制硝酸属于人工固氮 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它是氧化物 | |
| B. | 含有K、Cr、O三种元素 | |
| C. | 钾、铬、氧三种元素的质量比为 39:52:112 | |
| D. | 重铬酸钾是由2个钾原子、2个铬原子、7个氧原子构成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com