
| A. | 电解氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | 向AlCl3溶液中加入过量的氨水:Al3++4NH3.H2O═AlO${\;}_{2}^{-}$+4NH${\;}_{4}^{+}$+2H2O | |
| C. | Cu与浓硝酸反应制备N02:3Cu+8H++2NO${\;}_{3}^{-}$═3Cu2++2NO2↑+4H2O | |
| D. | 向KAl(S04)2溶液中滴加Ba(OH)2溶液至SO42-恰好沉淀完全:Al3++2SO${\;}_{4}^{2-}$+2Ba2++4OH-═AlO${\;}_{2}^{-}$+2BaSO4↓+2H2O |
分析 A.氢氧根离子与镁离子结合生成氢氧化镁沉淀;
B.氨水为弱碱,二者反应生成氢氧化铝沉淀;
C.铜与浓硝酸反应生成硝酸铜、二氧化氮气体和水,该反应不满足质量守恒定律和电荷守恒;
D.硫酸根离子恰好沉淀完全时,铝离子与氢氧根离子的物质的量之比为1:4,二者恰好反应生成偏铝酸根离子.
解答 解:A.电解氯化镁溶液生成氯气、氢气和氢氧化镁沉淀,正确的离子方程式为:Mg2++2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+Mg(OH)2↓,故A错误;
B.向AlCl3溶液中加入过量的氨水,反应生成氢氧化铝沉淀,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故B错误;
C.Cu与浓硝酸反应制备N02,正确的离子方程式为:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O,故C错误;
D.KAl(S04)2溶液中滴加Ba(OH)2溶液至SO42-恰好沉淀完全,反应生成硫酸钡沉淀、偏铝酸钾和水,反应的离子方程式为::Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O,故D正确;
故选D.
点评 本题考查了离子方程式的判断,为高考中的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法,如:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | ||
| C. |  | D. | 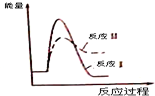 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 溶液 | 操作 | 现象 | |
| A | 滴有酚酞的明矾溶液 | 加热 | 溶液颜色变深 |
| B | 滴有酚酞的氨水 | 加入少量NH4Cl固体 | 溶液颜色变浅 |
| C | 滴有酚酞的CH3COONa溶液 | 加入少量NaOH固体 | 溶液颜色变浅 |
| D | 氯化铁溶液 | 加热 | 溶液颜色变浅 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在化学反应过程中,发生物质变化的同时不一定发生能量变化 | |
| B. | 生成物全部化学键形成时所释放的能量大于破坏反应物全部化学键所吸收的能量时,反应为吸热反应 | |
| C. | 对一个可逆反应来说,吸热反应一方的速率受温度变化的影响总是大于放热反应 | |
| D. | FeCl3+3KSCN?3KCl+Fe(SCN)3 体系中加入KCl固体,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 织物 | ① | ② | ③ |
| 灼烧时的气味 | 烧焦羽毛的气味 | 烧纸的气味 | 特殊的气味 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1>△H2 | B. | a=b | C. | a>b | D. | a<b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com