
����Ŀ��25��ʱ������ƽ�ⳣ����
��ѧʽ | CH3COOH | H2CO3 | HClO |
����ƽ�ⳣ�� | 1.8��10��5 | K1=4.3��10��7 K2=5.6��10��11 | 3.0��10��8 |
�ش��������⣺
��1����һ�����£�CH3COOH��Һ�д��ڵ���ƽ�⣺CH3COOH![]() CH3CH3COO��+H+ ��H��0 ,���з����У�����ʹ0.10mol��L��1CH3COOH��Һ��CH3COOH����̶��������_________��
CH3CH3COO��+H+ ��H��0 ,���з����У�����ʹ0.10mol��L��1CH3COOH��Һ��CH3COOH����̶��������_________��
a����������0.10mol��L��1��ϡ���� b������
c����ˮϡ����0.010mol��L��1 d����������������
��2�������ʵ���Ũ�ȵ�Na2CO3��NaClO��CH3COONa��NaHCO3��pH�ɴ�С��˳����____________��
��3��������0.1mol/L��CH3COOH��Һ��ˮϡ���̣����б���ʽ������һ����С����___________��
A��c��H+�� B��c��H+��/c��CH3COOH��
C��c��H+��c��OH���� D��c��OH����/c��H+��
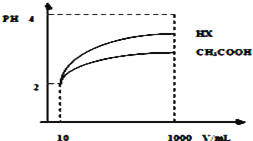
��4�����Ϊ10mLpH=2�Ĵ�����Һ��һԪ��HX�ֱ��ˮϡ����1000mL��ϡ����pH�仯��ͼ��ʾ����HX�ĵ���ƽ�ⳣ��____________��������������������������С�����������ƽ�ⳣ����ϡ�ͺ�HX��Һ��ˮ���������c��H+��______________������Һˮ�������c��H+����������������������������С��������
��5��25��ʱ��CH3COOH��CH3COONa�Ļ����Һ������û��ҺpH=6������Һ��c��CH3COO������c��Na+��=_________________����ȷ��ֵ����
���𰸡� bc Na2CO3��NaClO��NaHCO3 ��CH3COONa A ���� ���� 9.9��10��7mol/L
��������(1)����ĵ��������ȷ�Ӧ����ˮϡ�͡��������ȶ��ܴٽ�����ĵ��룬�ɴ˷����жϣ�
(2)�ɵ���ƽ�ⳣ���ж����Ե�ǿ��������Խǿ�����Ӧ�ε�ˮ��̶�Խ����Һ��pH��Խ��
(3)CH3COOH��Һ��ˮϡ���̣��ٽ����룬c(H+)��С��c(OH-)����Kw���䣻
(4)��ͼ��֪��ϡ����ͬ�ı�����HX��pH�仯�̶ȴ�������HXǿ������ƽ�ⳣ����ϡ�ͺ�HX�������ɵ�c(H+)С����ˮ�ĵ�����������С��
(5)25��ʱ�����ҺpH=6��c(H+)=1.0��10-6mol/L������Kw��֪��c(OH-)=1.0��10-8mol/L���ɵ���غ��֪��c(CH3COO-)-c(Na+)=c(H+)-c(OH-)��
(1)����ĵ��������ȷ�Ӧ����ˮϡ�͡��������ȶ��ܴٽ�����ĵ��룻a����������0.10molL-1��ϡ���ᣬ��Һ��������Ũ���������ƴ���ĵ��룬�����ĵ���̶Ƚ��ͣ��ʴ���b������ĵ��������ȷ�Ӧ������CH3COOH��Һ���ٽ�����ĵ��룬�����ĵ���̶�������ȷ��c����ˮϡ����0.010molL-1���ٽ�����ĵ��룬�����ĵ���̶�������ȷ��d���������������ᣬ����ĵ���ƽ��������Ӧ�����ƶ���������ĵ���̶Ƚ��ͣ��ʴ��ʴ�Ϊ��bc��
(2)�ɱ����е����ݿ�֪������CH3COOH��H2CO3��HClO��HCO3-����ˮ��̶�ΪNa2CO3��NaClO��NaHCO3 ��CH3COONa��pH�ɴ�С��˳����Na2CO3��NaClO��NaHCO3 ��CH3COONa���ʴ�Ϊ��Na2CO3��NaClO��NaHCO3 ��CH3COONa��
(3)A��CH3COOH��Һ��ˮϡ���̣��ٽ����룬c(H+)��С����Aѡ��B��CH3COOH��Һ��ˮϡ���̣��ٽ����룬c(H+)/c(CH3COOH)=n(H+)/n(CH3COOH)����ϡ�����б�ֵ���B��ѡ��C��ϡ���̣��ٽ����룬c(H+)��С��c(OH-)����c(H+)c(OH-)=Kw��Kw���䣬��C��ѡ��D��ϡ���̣��ٽ����룬c(H+)��С��c(OH-)������c(OH-)/c(H+)���D��ѡ���ʴ�Ϊ��A��
(4)��ͼ��֪��ϡ����ͬ�ı�����HX��pH�仯�̶ȴ�������HXǿ������ƽ�ⳣ����ϡ�ͺ�HX�������ɵ�c(H+)С����ˮ�ĵ�����������С������HX��Һ��ˮ���������c(H+)�ʴ�Ϊ�����ڣ�������
(5)25��ʱ�����ҺpH=6��c(H+)=1.0��10-6mol/L������Kw��֪��c(OH-)=1.0��10-8mol/L���ɵ���غ��֪��c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=9.9��10-7mol/L���ʴ�Ϊ��9.9��10-7mol/L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�ᾧˮ����Ļ�ѧʽΪA��H2O������Է�������ΪB����60��ʱm g �þ�������ngˮ�У��õ�V mL �ܶ�Ϊd g�� mL-1 �ı�����Һ����������ʽ���ж���ȷ������ ��
A. ����Һ���ʵ���Ũ��Ϊ(m/BV)mol��L��1
B. 60��ʱA ���ܽ��Ϊ(100m(B-18)/nB)g
C. ����Һ���ʵ���������Ϊ(m/(m+n))��100%
D. 60��ʱ����10g A Ͷ�뵽�ñ�����Һ�У������ľ�����������10g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȷ��ʾ���з�Ӧ�����ӷ���ʽ�ǣ� ��
A. Na2Sˮ�⣺S2- +2H2O H2S+2OH��
B. ��FeCl3��Һ�м���Mg��OH��2��3Mg��OH��2+2Fe3+ = 2Fe��OH��3+3Mg2+
C. �ô�����Һ��ˮ����2H++ CaCO3=Ca2++ H2O+CO2��
D. ��ͭΪ�缫��ⱥ��ʳ��ˮ��2Cl-+2H2O ![]() Cl2��+H2��+2OH-
Cl2��+H2��+2OH-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ�ؼס��ҵ�ԭ���������2��������������ȷ����(����)
A.������ͬһ����
B.һ������ͬһ����
C.һ�����ڲ�ͬ����
D.���ж�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ʾ���һ����Ӱ�죬��������������ص���
A.ˮ�ڽ��ʱ�������
B.NH3��PH3���ȶ��Ժ�
C.���ǻ�����ȩ�е�ȶ��ǻ�����ȩ��
D.���͡�Ũ���ᶼ����״
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ĵ绯ѧ��ʴԭ����ͼ��ʾ�������й�˵�����������ǣ� ��
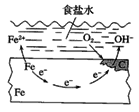
A. ��Ƭ�������̼��ʳ��ˮ�γ�������Сԭ���
B. ���缫����������Ӧ
C. �����ĵ缫��Ӧ����ʽΪO2��4e����2H2O=4OH��
D. ����һ��ʱ�����Ƭ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���������������ӳɺ�IJ���Ϊ ���밴Ҫ��ش��������⣺
���밴Ҫ��ش��������⣺
(1)����ϵͳ�������Ը����ʽ���������_________________________��
(2)���ò�������ΪȲ�������Ȳ���Ľṹ��ʽΪ___________________________��
(3)���ò�������Ϊһ��ϩ�����������________�ֽṹ���ṹ��ʽ�ֱ�Ϊ__________��
(4)��(2)��Ȳ�������ͬϵ����Ժϳɾ�����ϩ���ϡ���д���ù����еĻ�ѧ����ʽ����ע����Ӧ���ͣ�
��______________________________________��
��________________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)ij�¶�ʱ����2 L������X��Y��Z������������ʵ�����ʱ��仯��������ͼ��ʾ���ɴ˷������÷�Ӧ�Ļ�ѧ����_____________________________________���ӷ�Ӧ��ʼ��2 min��Z�ķ�Ӧ����Ϊ_____ mol��L-1��min-1��

(2)��������Ӧ�ġ�H<0,�����йظ÷�Ӧ���ʵ���������ȷ����_________��
A�������¶Ⱥ�����ѹǿ�������������Ӱٷ������ӿ췴Ӧ����
B��ʹ�ô�������ʹ��Ӧ�Ļ�ܽ��ͣ��ӿ췴Ӧ����
C������Ӽ�����������ײΪ��Ч��ײ
D�������¶ȣ�v����v������С��v����С�ı���С��v����С�ı���
(3)��һ�ܱ������з�����ӦN2(g)��3H2(g)![]() 2NH3(g)��H<0���ﵽƽ���ֻ�ı�ijһ������ʱ����Ӧ�����뷴Ӧʱ��Ĺ�ϵ��ͼ��ʾ�� t1��t3��t4ʱ�̷ֱ�ı��һ�������ǣ�
2NH3(g)��H<0���ﵽƽ���ֻ�ı�ijһ������ʱ����Ӧ�����뷴Ӧʱ��Ĺ�ϵ��ͼ��ʾ�� t1��t3��t4ʱ�̷ֱ�ı��һ�������ǣ�

A������ѹǿ B����Сѹǿ C�������¶� D�������¶� E���Ӵ��� F�����뺤��
t1ʱ��________��t3ʱ��________��t4ʱ��________(����ĸ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���һ�̶��ݻ����ܱ������н��з�Ӧ��A2 +B2![]() 2AB���������£�A2��B2��AB��Ϊ���塣�������һ����˵���÷�Ӧ�Ѵﵽ��ѧƽ��״̬���ǣ� ��
2AB���������£�A2��B2��AB��Ϊ���塣�������һ����˵���÷�Ӧ�Ѵﵽ��ѧƽ��״̬���ǣ� ��
A. ������ܶȲ��ٸı�ʱ
B. ����������ʵ������ٸı�ʱ
C. ��������и���ֵĺ������ٸı�ʱ
D. ÿ����1molB2ͬʱ��2molAB����ʱ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com