
为了测定呼吸作用的气体产物,某学生设计了如下装置,假定装置中的气体能够按下图中箭头所示方向稳定的运动,请回答下列问题:

(1)A瓶内的NaOH的作用是 ,B瓶内Ca (OH)2的作用是 ,D瓶内石灰水的作用是 .
(2)如果将C瓶中的萌发的种子换成绿色植物,实验结果会怎样 ,原因是 .如果测出绿色植物吸收作用的气体产物,怎样改进实验装置 .
(3)如果将C瓶中的种子换成乳酸菌培养液,D瓶中出现的现象为 ,原因是 .
(4)如将C瓶中的种子换成酵母培养液,则D瓶中出现的现象为 ,写出C瓶中的化学反应方程式 ,若在A前面加吸收O2的装置,则D出现的现象为 ,写出C中发生的反应方程式 .
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 “白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一.镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标.某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实验方案:
“白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一.镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标.某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实验方案:
| ||
| 2S×7.14 |
| ||
| 2S×7.14 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 1 | 10 |

查看答案和解析>>
科目:高中化学 来源: 题型:
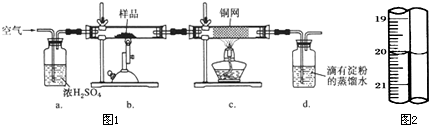
| 1 |
| 10 |
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com