
【题目】A、B、C、X是中学化学中常见的物质,它们之间的转化关系加下图所示(部分产物已略去)。请回答下列问题:
![]()
(1)若A能使湿润的红色石蕊试纸变蓝,C为红棕色的气体。A转化为B的化学方程为 ,
请写出实验室制取A的化学方程式: 。
(2)若B是一种常见的温室气体,则B转化为C的化学方程式 。
(3)若X是金属单质,向B、C溶液中分别滴加AgNO3溶液,均产生不溶于稀硝酸的白色沉淀,则B的化学式为 。保存C溶液常加入少量X,其目的是 ,请写出B转化为C的离子方程式: 。
【答案】(1)4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
(2)CO2+C![]() 2CO
2CO
(3)FeCl3 防止Fe2+被氧化 2Fe3++Fe=3Fe2+
【解析】
试题分析:(1)若A能使湿润的红色石蕊试纸变蓝,则A是氨气,C为红棕色的气体,则C是NO2,所以X是氧气,B是NO。则A转化为B的化学方程为4NH3+5O2![]() 4NO+6H2O;实验室制取氨气的化学方程式为Ca(OH)2+2NH4Cl
4NO+6H2O;实验室制取氨气的化学方程式为Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。
(2)若B是一种常见的温室气体,则B是CO2,所以A是氧气,X是碳,C是CO,则B转化为C的化学方程式为CO2+C![]() 2CO。
2CO。
(3)若X是金属单质,向B、C溶液中分别滴加AgNO3溶液,均产生不溶于稀硝酸的白色沉淀,则X是铁,A是氯气,B是氯化铁,C是氯化亚铁。氯化亚铁易被氧化,则保存C溶液常加入少量X,其目的是防止Fe2+被氧化。B转化为C的离子方程式为2Fe3++Fe=3Fe2+。


科目:高中化学 来源: 题型:
【题目】在下列溶液中,各组离子一定能够大量共存的是
A.使酚酞试液变红的溶液:Na+、Cl-、SO![]() 、Fe3+
、Fe3+
B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、MnO![]() 、Cl-
、Cl-
C.pH<7的溶液:K+、Ba2+、Cl-、Br-
D.碳酸氢钠溶液:K+、SO![]() 、Cl-、H+
、Cl-、H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在水溶液中能大量共存的是 ( )
A.K+、HCO3-、CO32-、Br- B.SO32-、HSO3-、OH-、K+
C.Fe3+、Cu2+、NO3-、SO32- D.H+、Na+、NO3-、Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2014年7月21日,世界各国领导人在南非德班共同商讨应对气候变化的道路—“拯救人类的最后机会”。要想节能减排下列属最有希望的新能源是( )
①天然气 ②煤 ③石油 ④水能 ⑤太阳能 ⑥地热能 ⑦风能 ⑧氢能
A. ①②③④ B. ⑤⑥⑦⑧ C. ③④⑤⑥ D. 除①②外
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类生存和发展的重要支柱。研究并有效地开发新能源在能源紧缺的今天具有重要的理论意义。已知H2与CO反应生成CH3OH的过程如图所示:
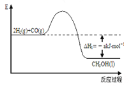
CO的燃烧热△H2=-bkJ·mol-1,CH3OH的燃烧热
△H3=-ckJ·mol-1。请根据以上信息,回答下列有关问题:
(1)甲醇是一种(填“可”或“不可”)再生能源,甲醇的官能团的电子式是 。
(2)CH3OH燃烧的热化学反应方程式为。
(3)H2的燃烧热△H=。
(4)一些化学键键能如下:C≡O为dkJ/mol;O=O为ekJ/mol;C=O为fkJ/mol。则由以上数据有b=
(用d、e、f的代数式表示)。
(5)H2和CO的混合气体nmol,充分燃烧共放出QkJ热量,则混合气体中H2和CO的物质的量之比为。
(6)CO与O2可以组成新型燃料电池,若该电池以Pt为电极,以KOH为电解质溶液,写出该燃料电池的正极反应式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组取一定质量的镁铝合金材料投入200mL稀硫酸中,待固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量(n)与加入Na0H溶液的体积(F)的关系如图所示。请回答下列问题:
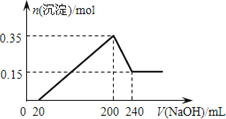
(1)加入NaOH溶液于20mL时,发生反应的离子方程式为_____________________。
(2)加入NaOH溶液体积为220mL时,沉淀的成分及其物质的量是___________。
(3)该合金材料中,镁、铝的物质的量之比为___________。
(4)H2SO4的物质的量浓度为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中的距离属于键长的是( )
A. 氨分子中两个氢原子间的距离
B. 氯分子中两个氯原子间的距离
C. 金刚石晶体中任意两个相邻的碳原子核间的距离
D. 氯化钠晶体中相邻的氯离子和钠离子的核间距离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁(简称PFS,化学式为[Fe(OH)n(SO4)3-n/2]m )是一种新型高效的无机高分子絮凝剂,广泛用于水的处理,现用一定质量的铁的氧化物(如下图)为原料来制取聚合硫酸铁。实验步骤如下: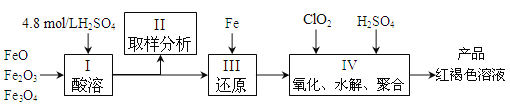
(1)实验室用18.4mol/L的浓硫酸配制250mL4.8mol/L的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需的玻璃仪器__________。定容操作中若俯视容量瓶刻度线,所配硫酸溶液浓度将___________(填“偏高”、“偏低”或“无影响”)
(2)步骤Ⅱ取样分析溶液中的Fe2+、Fe3+的含量,目的是_______。
A.确定下一步还原所需铁的量 B.控制溶液中Fe2+与Fe3+含量比
C.确定氧化Fe2+所需ClO2的量 D.确保铁的氧化物酸溶完全
(3)写出步骤Ⅳ中用ClO2氧化Fe2+时的离子方程式:____________________。(还原产物为Cl-)
(4)为了分析产品聚合硫酸铁溶液中SO42-与Fe3+物质的量之比,有人设计了以下操作:
(I)取25mL聚合硫酸铁溶液,加入足量的BaCl2溶液,产生白色沉淀,白色沉淀经过过滤,洗涤、干燥后,称重,其质量为mg。
(II)另取25mL聚合硫酸铁溶液,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250mL溶液,取该溶液25.00mL与0.1000 mol/L V mL KMnO4酸性溶液恰好完全反应,MnO4-被还原为Mn2+。
回答下列问题:
① 根据(II)步骤中判断Cu2+、Fe2+、MnO4-、Fe3+氧化性由强到弱的顺序:__________。
② 聚合硫酸铁中SO42-与Fe3+的物质的量之比为____________(用含m、V的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com