
【题目】下图是恒温条件下某化学反应的反应速率随反应时间变化的示意图。下列叙述与示意图不相符合的是( )

A.反应达到平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡状态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡状态Ⅱ
C.该反应达到平衡状态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡状态Ⅱ
D.同一种反应物在平衡状态Ⅰ和平衡状态Ⅱ时浓度不相等
【答案】C
【解析】
由图可知,该反应从正反应一端开始,正、逆反应速率相等时为平衡状态Ⅰ,然后,正反应速率大于逆反应速率,平衡向正反应方向移动,且改变条件的一瞬间逆反应速率不变,以此分析解答。
A.由平衡的特征可知,反应达平衡时,正反应速率和逆反应速率相等,故A正确;
B.该反应达到平衡状态Ⅰ后,增大反应物浓度,一瞬间正反应速率增大,逆反应速率不变,平衡正向移动,达到平衡状态Ⅱ,故B正确;
C.该反应达到平衡状态后,减小反应物浓度,平衡应逆向移动,逆反应速率大于正反应速率,与图象矛盾,故C错误;
D.该反应达到平衡状态Ⅰ后,改变条件使反应继续正向移动达到平衡状态Ⅱ,所以同一种反应物在平衡状态Ⅰ和平衡状态Ⅱ时浓度不相等,故D正确;
故选C。


科目:高中化学 来源: 题型:
【题目】氟及其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯商品名称为“特氟龙”,可做不粘锅涂层。它是一种准晶体,该晶体是一种无平移周期序、但有严格准周期位置序的独特晶体。可通过____方法区分晶体、准晶体和非晶体。
(2)基态锑(Sb)原子价电子排布的轨道式为____。[H2F]+[SbF6]—(氟酸锑)是一种超强酸,存在[H2F]+,该离子的空间构型为______,依次写出一种与[H2F]+具有相同空间构型和键合形式的分子和阴离子分别是_______、_________。
(3)硼酸(H3BO3)和四氟硼酸铵(NH4BF4)都有着重要的化工用途。
①H3BO3和NH4BF4涉及的四种元素中第二周期元素的第一电离能由大到小的顺序_____(填元素符号)。
②H3BO3本身不能电离出H+,在水中易结合一个OH﹣生成[B(OH)4]﹣,而体现弱酸性。[B(OH)4]﹣中B原子的杂化类型为_____。
③NH4BF4(四氟硼酸铵)可用作铝或铜焊接助熔剂、能腐蚀玻璃等。四氟硼酸铵中存在_______(填序号):
A 离子键 B σ键 C π键 D 氢键 E 范德华力
(4)SF6被广泛用作高压电气设备绝缘介质。SF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图(见图a)计算相联系的键能。则S—F的键能为_______kJ·mol-1。

(5)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃,密度为7.1g·cm-3。
①CuF比CuCl熔点高的原因是_____________;
② 已知NA为阿伏加德罗常数。CuF的晶胞结构如上“图b”。则CuF的晶胞参数a=__________nm (列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
GaN是制造5G芯片的材料,氮化镓和氮化铝LED可发出紫外光。回答下列问题:
(1)基态Ga原子的核外电子排布式为[Ar]____。
(2)根据元素周期律,元素的电负性Ga____ (填“大于”或“小于”,下同)As。
(3)科学家合成了一种阳离子为“N5n+”,其结构是对称的,5个N排成“V”形,每个N原子都达到8电子稳定结构,且含有2个氮氮三键;此后又合成了一种含有“N5n+”化学式为“N8”的离子晶体,其电子式为____,其中的阴离子的空间构型为____。
(4)组成相似的CaF3和GaCl3晶体,前者属于离子晶体,后者属于分子晶体。从F-和Cl-结构的不同分析其原因是________。
(5)原子晶体GaAs的晶胞参数a=xpm,它的晶胞结构如下图所示。该晶胞内部存在的共价键数为 ___;紧邻的As原子之间的距离为b,紧邻的As、Ca原子之间的距离为d,则b:d=____,该晶胞的密度为__g cm-3。(阿伏加德罗常数用NA表示)
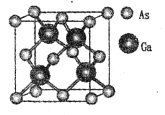
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四硼酸钠的阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示。下列说法不正确的是( )
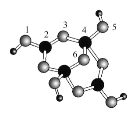
A.阴离子中三种元素的第一电离能:O>B>H
B.在Xm-中,硼原子轨道的杂化类型有sp2和sp3
C.配位键存在于4、5原子之间和4、6原子之间
D.m=2,NamX的化学式为Na2B4O5(OH)4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷水蒸气的重整反应是工业制备氢气的重要方式,其化学反应方程式为CH4(g)+H2O(g)![]() CO(g)+3H2(g)。回答下列问题:
CO(g)+3H2(g)。回答下列问题:
(1)已知CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3kJ·mol-1
CO(g)+0.5O2(g)=CO2(g) ΔH2=-283.0kJ·mol-1
H2(g)+0.5O2(g)=H2O(l) ΔH3=-285.8kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH4=-41.0kJ·mol-1
则甲烷水蒸气重整反应的ΔH=_____kJ·mol-1。
(2)通过计算机模拟实验,对400~1200℃、操作压强为0.1MPa条件下,不同水碳比(1~10)进行了热力学计算,反应平衡体系中H2的物质的量分数与水碳比、平衡温度的关系如图所示。
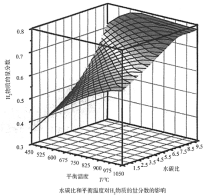
①温度一定时,H2的物质的量分数与水碳比(1~10)的关系是_____,产生该结论的原因是_____。
②据模拟实验可知,平衡温度为900℃,水碳比为1.0时,H2的物质的量分数为0.6,CH4的转化率为_____,其压强平衡常数为_____;反应速率方程为v=kp(CH4)p-1(H2),此时反应速率v=_____。
(已知:气体分压=气体的物质的量分数×总压,速率方程中k为速率常数)。
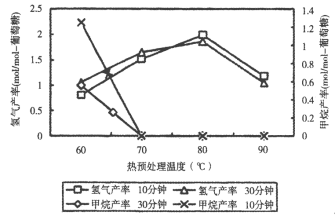
(3)厌氧细菌可将葡萄糖转化为CH4和H2,pH为5.5时不同热预处理温度和时间下的甲烷和氢气的产率如图所示,若要提高H2的产率,最佳温度为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g) ![]() 2CO2(g)+S(l) ΔH<0,若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
2CO2(g)+S(l) ΔH<0,若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
A.平衡时,其他条件不变,升高温度可提高 SO2 的转化率
B.其他条件不变,缩小容器体积,平衡正反应方向移动,该反应的平衡常数不变
C.平衡前,充入氩气,容器内压强增大,反应速率加快
D.平衡时,其他条件不变,分离出硫,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F、G,它们之间能发生如图反应(图中某些反应的产物及条件没有全部标出)

根据以上信息填空:
(1)写出下列物质的化学式:A______ G__________ ;
(2)纯净的气体甲在气体乙中燃烧的现象:______________________________________;
(3)写出下列反应的离子方程式:反应①_________________________;反应④____________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组按如下实验过程(固定、加热及盛接仪器略)证明了海带中存在碘元素:

下列说法不正确的是
A.步骤①需要将干海带放入坩埚中灼烧
B.步骤②反应的离子方程式为:2I-+2H++H2O2=I2+2H2O
C.步骤③操作后,观察到试管中溶液变为蓝色,可以说明海带中含有碘元素
D.若步骤③加入的试剂是CCl4,振荡、静置后,液体分层,上层紫色,下层无色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对三联苯(![]() )是一种有机合成的中间体。下列关于对三联苯的说法中正确的是
)是一种有机合成的中间体。下列关于对三联苯的说法中正确的是
A.对三联苯属于苯的同系物
B.对三联苯分子中至少有16个原子共平面
C.对三联苯的一氯取代物有6种
D.0.2mol对三联苯在足量的氧气中完全燃烧消耗5.1molO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com