
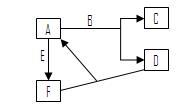
科目:高中化学 来源:不详 题型:单选题
| A.全部可以 | B.仅②不可以 | C.仅②⑤不可以 | D.③④可以 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
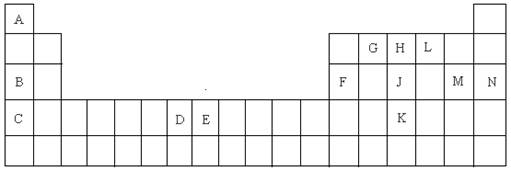
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
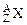 ,含中子总数为3.5×6.02×1023,同质量的该金属和足量稀H2SO4反应共有0.2mol电子发生转移,生成6.02×1022个阳离子
,含中子总数为3.5×6.02×1023,同质量的该金属和足量稀H2SO4反应共有0.2mol电子发生转移,生成6.02×1022个阳离子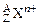 ,这些阳离子共有3.0×6.02×1023个质子。试求z、n和A值。
,这些阳离子共有3.0×6.02×1023个质子。试求z、n和A值。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氧化性强弱:F2<Cl2 | B.金属性强弱:K<Na |
| C.氢化物稳定性:H2S<HCl | D.碱性强弱:NaOH<Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Sr(锶)的碳酸盐难溶于水 | B.Tl(铊)的氢氧化物是两性氢氧化物 |
| C.SiH4比CH4更稳定 | D.H3AsO4酸性比H3PO4强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 甲 | 乙 | | ||||||||
| 丙 | 丁 | 戊
查看答案和解析>> 科目:高中化学 来源:不详 题型:单选题 对Na、Mg、Al的有关性质的叙述正确的是:
查看答案和解析>> 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |