
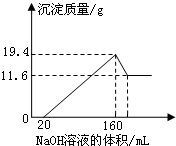
 将一定质量的镁铝合金样品全部溶于100mL某浓度的盐酸中.向所得溶液中滴加5.0mol/L的NaOH溶液,生成沉淀质量与加入的NaOH溶液体积关系如图所示.求:
将一定质量的镁铝合金样品全部溶于100mL某浓度的盐酸中.向所得溶液中滴加5.0mol/L的NaOH溶液,生成沉淀质量与加入的NaOH溶液体积关系如图所示.求:| n |
| V |
| 7.8g |
| 78g/mol |
| 11.6g |
| 58g/mol |
| 0.8mol |
| 0.1L |


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
 将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求:
将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求:查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究小组将一定质量的镁铝合金材料投入200mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n(mol)与加入NaOH溶液的体积V(mL)的变化如图所示.
某研究小组将一定质量的镁铝合金材料投入200mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n(mol)与加入NaOH溶液的体积V(mL)的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
 将一定质量的镁铝合金投入100ml一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5mol?L-1 NaOH溶液至过量,生成沉淀的质量与加入的NaOH溶液的体积关系如图所示.求:
将一定质量的镁铝合金投入100ml一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5mol?L-1 NaOH溶液至过量,生成沉淀的质量与加入的NaOH溶液的体积关系如图所示.求:查看答案和解析>>
科目:高中化学 来源: 题型:
 将一定质量的镁铝合金投入100mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5mol/L的NaOH溶液到过量,生成沉淀的质量与加入的NaOH溶液的体积关系如图所示.由图中数据计算:
将一定质量的镁铝合金投入100mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5mol/L的NaOH溶液到过量,生成沉淀的质量与加入的NaOH溶液的体积关系如图所示.由图中数据计算:查看答案和解析>>
科目:高中化学 来源: 题型:
 将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求:
将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com