
相同温度下,在水中分别加入下列物质,若用 表示水的离子积,a表示水的电离度,能使
表示水的离子积,a表示水的电离度,能使 的值增大的是
的值增大的是
A.NaOH???????? B.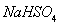 ???????? C.HC1???????? D.
???????? C.HC1???????? D.
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
- 3 |
- 3 |
- 3 |
- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(16分)物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识的回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为 。
(2)B为0.1 mol·L-1NaHCO3溶液,在NaHCO3溶液中存在的各种平衡体系为(用离子方程式表示): ;实验测得NaHCO3溶液的pH > 7,请分析NaHCO3溶液显碱性的原因: 。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入 ,目的是 ;
若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为 。
(4)D为含有足量AgCl固体的饱和溶液,氯化银在水中存在沉淀溶解平衡:AgCl(S)Ag+(aq)+ Cl-(aq) 在25℃时,氯化银的Ksp= 1.8×10-10 ;25℃时现将足量氯化银分别放入①100mL蒸馏水中②100mL 0.2 mol·L-1AgNO3溶液中③100mL 0.1 mol·L-1氯化铝溶液中④100mL 0.1 mol·L-1盐酸溶液中。充分搅抖后,相同温度下银离子浓度由大到小的顺序是 (填写序号);②中氯离子的浓度为 mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2010年浙江省浙东北三校高二第二学期期中联考化学试题 题型:填空题
(共9分,每空1分)物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识的回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为
。
(2)B为0.1 mol·L-1NaHCO3溶液,在NaHCO3溶液中存在的各种平衡体系为(用离子方
程式表示): ; ;
实验测得NaHCO3溶液的pH > 7,请分析NaHCO3溶液显碱性的原因:
。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入 ,目的是 ;
若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为
。
(4)D为含有足量AgCl固体的饱和溶液,氯化银在水中存在沉淀溶解平衡:
AgCl(S)  Ag+(aq)+ Cl-(aq) 在25℃时,氯化银的Ksp = 1.8×10-10
Ag+(aq)+ Cl-(aq) 在25℃时,氯化银的Ksp = 1.8×10-10
25℃时,现将足量氯化银分别放入:①100mL蒸馏水中;②100mL 0.2 mol·L-1AgNO3溶液中;③100mL 0.1 mol·L-1氯化铝溶液中;④100mL 0.1 mol·L-1盐酸溶液中。充分搅抖后,相同温度下银离子浓度由大到小的顺序是 (填写序号);②中氯离子的浓度为 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014届广东省陆丰市高二上学期期末考试化学试卷(解析版) 题型:填空题
(1)在25℃、101kPa下,16g甲烷燃烧生成CO2和液态水时放热889.6kJ。则表示甲烷燃烧的热化学方程式为_________________________________________________。
(2) 下列说法正确的是(填序号)__ __:(漏选得1分,错选、多选得0分)
A.相同温度下,0.1 mol?L-1NH4Cl溶液中NH4+的浓度比0.1 mol?L-1氨水中NH4+的浓度大;
B.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小;
C.电解饱和食盐水时,阳极得到氢氧化钠溶液和氢气;
D.对于Al(OH)3(s) Al(OH)3(aq)
Al(OH)3(aq) Al3+(aq)+3OH-(aq),前段为溶解平衡,后段是电
Al3+(aq)+3OH-(aq),前段为溶解平衡,后段是电
离平衡;
E. 除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比
MgCO3的大;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com