
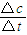 计算;
计算;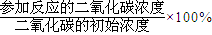 ;
; CO+3H2,
CO+3H2, CO+3H2;
CO+3H2;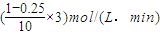 =0.225mol?-1?min-1,故正确;
=0.225mol?-1?min-1,故正确;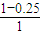 ×100%=75%,故错误;
×100%=75%,故错误;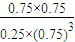 (mol/L)2=
(mol/L)2= (mol/L)2,故正确;
(mol/L)2,故正确;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| 16 |
| 3 |
| 容器 | 容器1 | 容器2 | 容器3 |
| 反应物投入量(始态) | 1molCO2、3molH2 | 0.5molCO2、1.5molH2 | 1molCH3OH、1molH2O |
| CH3OH的平衡浓度/mol?L-1 | c1 | c2 | c3 |
| 平衡时体系压强/Pa | p1 | p2 | p3 |
查看答案和解析>>
科目:高中化学 来源: 题型:022
近年来,北京、成都等市率先在公交车和出租车中推行用天然气代替汽油作燃料的改革,取得了显著进展.走上街头你会发现不少公交车和出租车上印有“CNG”的标志,代表它们是以天然气作为燃料的汽车.试问:(1)成都市政府推广这一改革的主要目的是________(填字母).
(2)天然气是___________在隔绝空气的条件下,经微生物发酵作用而生成的,因此,天然气中贮藏的化学能最终来自于____________.
(3)天然气的主要成分是_________,该主要成分若出现于煤矿的坑道内,并达到一定浓度时遇____________,便会立即出现瓦斯爆炸.
(4)天然气的主要成分是一种很好的燃料.已知4 g该主要成分完全燃烧生成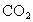 气体和液态
气体和液态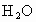 ,放出222.5kJ的热量,则上述成分燃烧的热化学方程式为__________.
,放出222.5kJ的热量,则上述成分燃烧的热化学方程式为__________.
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:058
近年来,北京、成都等市率先在公交车和出租车中推行用天然气代替汽油作燃料的改革,取得了显著进展.走上街头你会发现不少公交车和出租车上印有“CNG”的标志,代表它们是以天然气作为燃料的汽车.试问:(1)成都市政府推广这一改革的主要目的是________(填字母).
(2)天然气是___________在隔绝空气的条件下,经微生物发酵作用而生成的,因此,天然气中贮藏的化学能最终来自于____________.
(3)天然气的主要成分是_________,该主要成分若出现于煤矿的坑道内,并达到一定浓度时遇____________,便会立即出现瓦斯爆炸.
(4)天然气的主要成分是一种很好的燃料.已知4 g该主要成分完全燃烧生成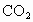 气体和液态
气体和液态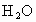 ,放出222.5kJ的热量,则上述成分燃烧的热化学方程式为__________.
,放出222.5kJ的热量,则上述成分燃烧的热化学方程式为__________.
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省泰安市高三第二轮复习质量检测理综化学试卷(解析版) 题型:计算题
近年来,以天然气等为原料合成甲醇的难题被一一攻克,极大地促进了甲醇化学的发展。
(1)与炭和水蒸气的反应相似,以天然气为原料也可以制得CO和H2,该反应的化学方程式为_________。
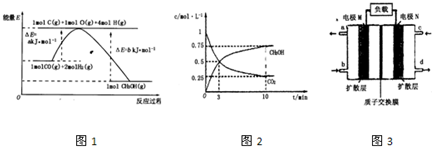
(2)合成甲醇的一种方法是以CO和H2为原料,其能量变化如图所示:
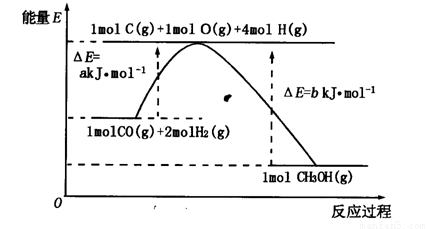
由图可知,合成甲醇的热化学方程式为________________________________________。
(3)以CO2为原料也可以合成甲醇,其反应原理为:CO2(g)+3H2(g)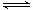 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
①在lL的密闭容器中,充入1molCO2和3molH2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时问变化如图所示:
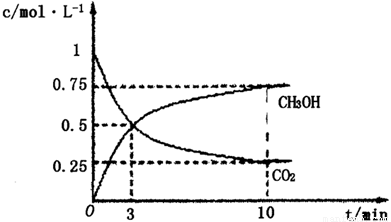
则下列说法正确的是_________________(填字母);
A.3min时反应达到平衡
B.0~10min时用H2表示的反应速率为0.225mol·-1·min-1
C.CO2的平衡转化率为25%
D.该温度时化学平衡常数为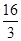 (mol/L)-2
(mol/L)-2
②在相同温度、相同容积的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
|
容器 |
容器1 |
容器2 |
容器3 |
|
反应物投入量(始态) |
1molCO2、3molH2 |
0.5molCO2、1.5molH2 |
1molCH3OH、1molH2O |
|
CH3OH的平衡浓度/mol•L-1 |
c1 |
c2 |
c3 |
|
平衡时体系压强/Pa |
p1 |
p2 |
p3 |
则下列各量的大小关系为c1___________c3,p2_________p3(填“大于”、“等于”或“小于”)。
(4)近年来,甲醇燃料电池技术获得了新的突破,如图所示为甲醇燃料电池的装置示意图。电池工作时,分别从b、c充入CH3OH、O2,回答下列问题:
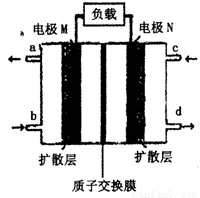
①从d处排出的物质是___________,溶液中的质子移向电极__________(填“M”或“N”);
②电极M上发生的电极反应式为__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com