
【题目】(1)密闭容器中mA(g)+nB(g)![]() pC(g),反应达到平衡,经测定增大压强P时,A的转化率随P而变化的曲线如图。则:
pC(g),反应达到平衡,经测定增大压强P时,A的转化率随P而变化的曲线如图。则:
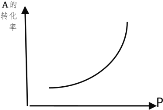
①增大压强,A的转化率___平衡向___移动,达到平衡后,混合物中C的浓度___。
②上述化学方程式中的系数m、n、p的正确关系是____。
③当降低温度时,C的浓度减小,正反应是___热反应。
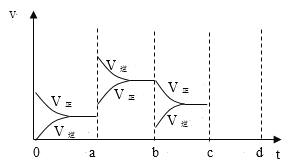
(2)如图表示在密闭容器中反应:2SO2(g)+O2(g)![]() 2SO3(g)△H<0,达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a-b过程中改变的条件可能是___;b-c过程中改变的条件可能是____;若增大压强时,反应速度变化情况画在c-d处。___
2SO3(g)△H<0,达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a-b过程中改变的条件可能是___;b-c过程中改变的条件可能是____;若增大压强时,反应速度变化情况画在c-d处。___
【答案】提高 右(正方向) 增大 m+n>p 吸 升温 减小SO3浓度 
【解析】
根据正逆反应速率的变化结合温度、压强对反应速率和化学平衡的影响判断,a时逆反应速率大于正反应速率,且正逆反应速率都增大,b时正反应速率大于逆反应速率,注意逆反应速率突然减小的特点;根据影响化学平衡移动的因素进行判断得出正确结论,升高温度,平衡向着吸热的方向移动;增大压强,平衡向着气体体积减小的方向移动。
(1) ①由图象可以知道,增大压强,A的转化率升高,平衡正向移动,C的质量分数增大,
因此,本题正确答案是:提高;正向,增大;
②增大压强,平衡正向移动,故 m+n>p ;因此,本题正确答案是:故m+n>p ;
③当降低温度时,C的浓度减小,平衡逆向移动,A的转化率降低,正反应是吸热反应,
因此,本题答案是:吸
(2)a时逆反应速率大于正反应速率,且正逆反应速率都增大,说明平衡应向逆反应方向移动,该反应的正反应放热,应为升高温度的结果;b时正反应速率不变,逆反应速率减小,在此基础上逐渐减小,应为减小生成物的原因;若增大压强时,平衡向正反应方向移动,则正逆反应速率都增大,且正反应速率大于逆反应速率,图象应为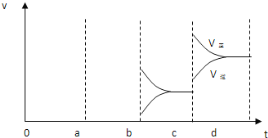 ,
,
因此,本题正确答案是:升高温度;减小SO3浓度;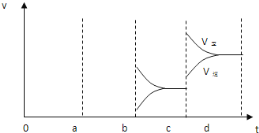 .
.


科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是( )

A. 如上图所示是测定中和热的简易装置,大小两烧杯间填满碎泡沫塑料的作用是固定小烧杯
B. 若用50 mL 0.55 mol·L-1的氢氧化钠溶液,分别与50 mL 0.50 mol·L-1的盐酸和50 mL0.50 mol·L-1的硫酸充分反应,两反应测定的中和热不相等
C. 实验时需要记录初始温度T1和最高温度T2
D. 做一次实验根据公式即可得出中和反应的反应热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废定影液含Ag(S2O3)23-和Br-等,实验室从中回收Ag和Br2的主要步骤为:向废定影液中加入Na2S溶液沉淀银离子,过滤、洗涤、干燥,灼烧Ag2S制取金属Ag;制取Cl2并将Cl2通入滤液中氧化Br-,再用苯萃取分液。其中部分实验操作的装置如图所示,下列叙述正确的是( )
A.用装置甲分离Ag2S时,用玻璃棒不断搅拌
B.用装置乙在通风橱中高温灼烧Ag2S制取Ag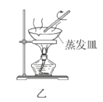
C.用装置丙制备Cl2 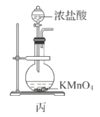
D.用装置丁分液时,先放出水层再换个烧杯继续放出有机层
查看答案和解析>>
科目:高中化学 来源: 题型:
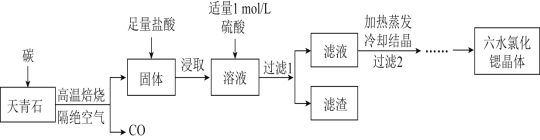
【题目】锶(Sr)为第五周期IIA族元素,其化合物六水氯化锶(SrCl26H2O)是实验室重要的分析试剂,工业上常以天青石(主要成分为SrSO4)为原料制备,生产流程如图:
已知:①经盐酸浸取后的溶液中除含有Sr2+和Cl-外,还有少量的Ba2+杂质。
②BaSO4的溶度积常数为1.1×10-10,SrSO4的溶度积常数为3.3×10-7。
③SrCl26H2O的摩尔质量为267g/mol。
(1)工业上天青石焙烧前应先研磨粉碎,其目的是__。
(2)工业上天青石隔绝空气高温焙烧时,若0.5molSrSO4中只有S元素被还原,且转移了4mol电子。则该反应的化学方程式为__。
(3)浸取后加入硫酸的目的是 用离子方程式表示 __。为了提高原料的利用率,滤液中Sr2+的浓度应不高于__mol/L。
(注:此时滤液中Ba2+浓度为1.0×10-5mol/L)。
(4)产品纯度检测:称取1.000g产品溶解于适量水中,向其中加入含AgNO30.01mol的AgNO3溶液。溶液中除Cl-外,不含其它与Ag+反应的离子 ,待Cl-完全沉淀后,滴入1—2滴含Fe3+的溶液作指示剂,用0.2000mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出。已知:SCN-先与Ag+反应。
①滴定反应达到终点的现象是__。
②若滴定过程用去上述浓度的NH4SCN溶液20.00mL,则产品中SrCl26H2O的质量百分含量为___(保留3位有效数字)。
(5)由SrCl26H2O晶体制取无水氯化锶的主要仪器除了酒精灯、泥三角、三脚架外,还有___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:![]() 平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是
平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是
A.x+y﹤zB.平衡向正反应方向移动
C.B的转化率降低D.C的体积分数升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)若反应2NO(g)+O2(g)![]() 2NO2的平衡常数为K1,2NO2(g)
2NO2的平衡常数为K1,2NO2(g)![]() N2O4(g)的平衡常数为K2,则反应2NO(g)+O2(g)
N2O4(g)的平衡常数为K2,则反应2NO(g)+O2(g)![]() N2O4(g)的平衡常数K=___。
N2O4(g)的平衡常数K=___。
(2)25℃、101KPa时,1Kg乙醇充分燃烧后放出的热量为29714kJ,则乙醇的燃烧热△H=__。
(3)反应mA+nB![]() pC在某温度下达到平衡。
pC在某温度下达到平衡。
①若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关是___。
②若C为气体,且m+n=p,在加压时化学平衡发生移动,则平衡必定向___方向移动。
③如果在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为__态。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,0.1 mol/L 的某二元酸 H2A 溶液中,可能存在的所有含 A 粒子的物质的量分数随 pH 变化的关系如图所示。下列说法不正确的是

A.H2A 的电离方程式:H2A=H+ + HA-
B.NaHA 溶液显酸性
C.等物质的量浓度的 NaHA 和Na2A 溶液等体积混合,离子浓度大小关系为:c(Na+)>c(A2-)>c(HA-)
D.pH = 5 时,在NaHA 和 Na2A 的混合溶液中: c(HA-) : c(A2-)= 100:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某同学设计用来验证SO2性质的微型实验装置。分析实验,下列结论不正确的是( )
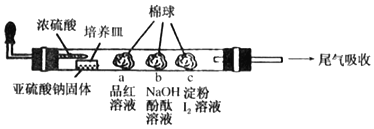
A.棉球a褪色,说明SO2具有漂白性
B.棉球b褪色,说明SO2具有氧化性
C.棉球c褪色,说明SO2具有还原性
D.可以用氨水或高锰酸钾溶液吸收尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数,下列说法正确的是( )
A.含有4molHCl的浓盐酸与足量MnO2反应,生成1molCl2
B.常温常压下,16gO2所含的电子数为8NA
C.标准状况下,22.4LSO3中所含的SO3分子数为NA
D.78gNa2O2与足量水充分反应时电子转移数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com