
工业上采用乙苯与CO2脱氢生产重要化工原料苯乙烯

其中乙苯在CO2气氛中的反应可分两步进行

(1)上述乙苯与CO2反应的反应热△H为________________________。
(2)①乙苯与CO2反应的平衡常数表达式为:K=______________________。
②下列叙述不能说明乙苯与CO2反应已达到平衡状态的是_____________________。
a.v正(CO)=v逆(CO) b.c(CO2)=c(CO)
c.消耗1mol CO2同时生成1molH2O d.CO2的体积分数保持不变
(3)在3L密闭容器内,乙苯与CO2的反应在三种不同的条件下进行实验,乙苯、CO2的起始浓度分别为1.0mol/L和3.0mol/L,其中实验I在T1℃、0.3MPa,而实验II、III分别改变了实验其他条件;乙苯的浓度随时间的变化如图I所示。

①实验I乙苯在0~50min时的反应速率为_______________。
②实验II可能改变条件的是__________________________。
③图II是实验I中苯乙烯体积分数V%随时间t的变化曲线,请在图II中补画实验Ⅲ中苯乙烯体积分数V%随时间t的变化曲线。
(4)若实验I中将乙苯的起始浓度改为1.2mol/L,其他条件不变,乙苯的转化率将(填“增大”、“减小”或“不变”),计算此时平衡常数为_____________________。
(16分)(1)-166kJ/mol(2分)
(2)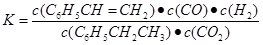 bc(每空2分 共4分)
bc(每空2分 共4分)
(3)①0.012mol/(L•min) ②加入催化剂
③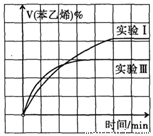 (每空2分共6分)
(每空2分共6分)
(4)减小(2分) 0.225 (2分)
【解析】
试题分析:(1)观察三个热化学方程式,发现已知焓变的A+B可以得到乙苯与二氧化碳的反应,根据盖斯定律,则乙苯与二氧化碳反应的焓变=△H1+△H2=[(—125)+(—41)]kJ/mol=—166kJ/mol;(2)①观察乙苯与二氧化碳反应的化学方程式,发现各组分都是气体,系数都是1,则该反应的平衡常数K=[c(C6H5CH=CH2)•c(CO) •c(H2O)]/[c(C6H5CH2CH3) •c(CO2)];②同一种物质表示的正反应速率等于逆反应速率,说明已达平衡,故a错误;虽然各组分的变化浓度之比等于化学方程式中系数之比,但是各组分的平衡浓度之比不一定等于化学方程式中系数之比,因此二氧化碳和一氧化碳浓度相等时反应不一定达到平衡,故b正确;二氧化碳和水的系数之比等于1∶1,消耗1molCO2同时生成1molH2O,说明不同物质的正反应速率等于化学方程式中系数之比,缺少逆反应速率,因此不能说明达到平衡,故c正确;二氧化碳是反应物,其体积分数逐渐减小,若保持不变,说明反应已达平衡,故d错误;(3)①观察图I,0~50min内△c(乙苯)=(1.0—0.4)mol/L=0.6mol/L,由于v=△c/△t,则v(乙苯)= 0.6mol/L÷50min=0.012mol/(L•min);②对比图I、图II,发现I→II时,单位时间内乙苯的变化浓度增大,说明反应速率加快,但是平衡时乙苯的浓度相等,说明平衡没有移动;由于乙苯与二氧化碳的反应是气体体积增大的放热反应,根据浓度、压强、温度和催化剂对化学平衡的影响规律推断,实验II可能改变的条件是加入催化剂;③同理,推断实验I→III时,反应速率增大,平衡向逆反应方向移动,说明改变的条件是升高温度,因此画出的曲线满足以下几个要点:起点与实验I相同,未达平衡前,实验III的反应速率比I大,平衡后苯乙烯的体积分数比实验I的小;(4)增大乙苯的浓度,虽然平衡右移,乙苯的变化浓度增大,但是乙苯的起始浓度也增大,且变化浓度增大的程度小于起始浓度增大的程度,因此乙苯的转化率减小;平衡常数只与温度有关,与浓度改变无关,因此实验I中各组分的平衡浓度计算出的平衡常数就是此时的平衡常数,依题意可知实验I反应中各组分的起始、变化、平衡浓度,则:
C6H5CH2CH3(g)+CO2(g)
 C6H5CH=CH2(g)+CO(g)+H2O(g)
C6H5CH=CH2(g)+CO(g)+H2O(g)
起始浓度/ mol•Lˉ1 1.0 3.0 0 0 0
变化浓度/ mol•Lˉ1 0.6 0.6 0.6 0.6 0.6
平衡浓度/ mol•Lˉ1 0.4 2.4 0.6 0.6 0.6
K=[c(C6H5CH=CH2)•c(CO) •c(H2O)]/[c(C6H5CH2CH3) •c(CO2)]=( 0.6×0.6×0.6)/( 0.4×2.4)=0.225。
考点:考查化学反应大题,涉及盖斯定律、平衡常数表达式、化学平衡状态、平均反应速率、外界条件对化学反应速率和化学平衡的影响、化学反应速率和化学平衡图像、平衡常数计算等。


科目:高中化学 来源: 题型:



| c(C6H5CH=CH2)?c(CO)?c(H2O) |
| c(C6H5CH2CH3)c(CO2) |
| c(C6H5CH=CH2)?c(CO)?c(H2O) |
| c(C6H5CH2CH3)c(CO2) |

查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 化学反应速率和化学平衡练习卷(解析版) 题型:填空题
工业上采用乙苯与CO2脱氢生产重要化工原料苯乙烯
 (g)+CO2(g)
(g)+CO2(g)
 (g)+CO(g)+H2O(g) ΔH=-166 kJ·mol-1
(g)+CO(g)+H2O(g) ΔH=-166 kJ·mol-1
(1)①乙苯与CO2反应的平衡常数表达式为:K= 。
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。

(2)在3 L密闭容器内,乙苯与CO2的反应在三种不同的条件下进行实验,乙苯、CO2的起始浓度分别为1.0 mol·L-1和3.0 mol·L-1,其中实验Ⅰ在T1℃,0.3 MPa,而实验Ⅱ、Ⅲ分别改变了实验其他条件;乙苯的浓度随时间的变化如图1所示。
 ??????????????????????
?????????????????????? 
????????? 图1???????????????????????????????????? 图2
①实验Ⅰ乙苯在0~50 min时的反应速率为 。
②实验Ⅱ可能改变的条件是 。
③图2是实验Ⅰ中苯乙烯体积分数V%随时间t的变化曲线,请在图2中补画实验Ⅲ中苯乙烯体积分数V%随时间t的变化曲线。
(3)若实验Ⅰ中将乙苯的起始浓度改为1.2 mol·L-1,其他条件不变,乙苯的转化率将 (填“增大”“减小”或“不变”),计算此时平衡常数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com