
下列说法不正确的是
A. 氕、氘、氚是具有相同质子数,不同中子数的三种核素
B. CH3CH(CH3)2的名称叫2-甲基丁烷
C. CH3CH2NO2和H2NCH2COOH互为同分异构体
D. 金刚石和石墨互为同素异形体
科目:高中化学 来源:2016-2017学年江西省南昌市高二上学期期末考试化学试卷(解析版) 题型:选择题
既能通过化学反应使溴水褪色,又能使酸性高锰酸钾溶液褪色的是
A. 苯 B. 乙烷 C. 聚乙烯 D. 丙烯
查看答案和解析>>
科目:高中化学 来源:2017届江苏省、溧水高级中学)等六校高三2月联考化学试卷(解析版) 题型:选择题
在给定条件下,下列选项中所示的物质间转化均能一步实现的是
A. 
B. 
C. 
D. 
查看答案和解析>>
科目:高中化学 来源:2017届浙江省台州市高三上学期期末质量评估考试化学试卷(解析版) 题型:选择题
常温下,向20mL浓度为0.1000mol/L的盐酸中逐滴加入0.1000mol/L的氨水,PH随氨水体积的变化如图。下列说法不正确的是
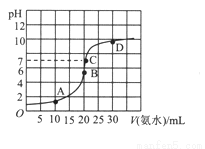
A. 在B点时:c(H+)=c(OH-)+c(NH3·H2O)
B. 在C点时:c(Cl-)<c(NH4+)+c(NH3·H2O)
C. A点与B点相比:2n(NH4+)A>n(NH4+)B
D. 从C到D的过程中,可能出现:c(Cl-)>c(NH4+)
查看答案和解析>>
科目:高中化学 来源:2017届浙江省台州市高三上学期期末质量评估考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A. 通过盐析作用析出的蛋白质固体不溶于水
B. 淀粉、纤维素和葡萄糖均可发生水解
C. 油脂在酸性条件下的水解反应叫做皂化反应
D. 紫外线可使蛋白质变性,可利用紫外线进行消毒
查看答案和解析>>
科目:高中化学 来源:2017届浙江省台州市高三上学期期末质量评估考试化学试卷(解析版) 题型:选择题
下列说法不正确的是
A. 单晶硅是石英的主要成分
B. 钠钾合金可用于快中子反应堆的热交换剂
C. 小苏打可用于焙制糕点
D. 水玻璃暴露在空气中会发生变质
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三下学期开学考试化学试卷(解析版) 题型:简答题
随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点
(1)氨氮是造成水体富营养化的重要因素之一,用次氯酸钠水解生成的次氯酸将水中的氨氮(用NH3表示)转化为氮气除去,其相关反应的主要热化学方程式如下:
反应①:NH3(aq)+HClO(aq)= NH2Cl(aq)+H2O(l)△H1= akJ•mol﹣1
反应②:NH2Cl(aq)+HClO(aq)= NHCl2(aq)+H2O(I)△H2= bkJ•mol﹣1
反应③:2NHCl2(aq)+H2O(l)= N2(g)+HClO(aq)+3HCl(aq)△H3= ckJ•mol﹣1
① 2NH3(aq)+3HClO(aq)= N2(g)+3H2O(I)+3HCl(aq)的△H=______。
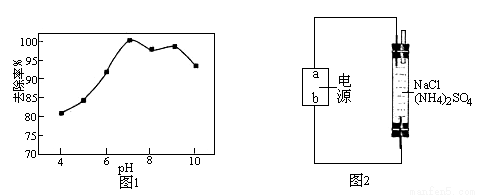
② 溶液pH对次氯酸钠去除氨氮有较大的影响(如图1所示)。在pH较低时溶液中有无色无味的气体生成,氨氮去除效率较低,其原因是_________________。
③ 用电化学法也可以去除废水中氨氮.在蒸馏水中加入硫酸铵用惰性电极直接电解发现氨氮去除效率极低,但在溶液中再加入一定量的氯化钠后,去除效率可以大大提高。反应装置如图2所示,b为电极__极,电解时阴极的电极反应式为_____________。
(2)“低碳经济”正成为科学家研究的主要课题。
① 以二氧化钛表面覆盖Cu2Al2O4 为催化剂,可以将CO2 和CH4 直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如右图所示。250~300 ℃时,温度升高而乙酸的生成速率降低的原因是__________________。
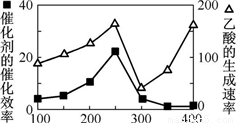
② 为了提高该反应中CO2的转化率,可以采取的措施是_____________。(写一条即可)
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三下学期开学考试化学试卷(解析版) 题型:选择题
下列有关物质的性质与用途具有对应关系的是
A. Al具有良好延展性和抗腐蚀性,可制成铝箔包装物品
B. 浓硫酸具有脱水性,可用于干燥NH3、SO2等
C. 明矾易溶于水,可用作净水剂
D. 苯酚具有强氧化性,可加入药皂起到杀菌消毒的作用
查看答案和解析>>
科目:高中化学 来源:2017届山东省菏泽市高三上学期期末学分认定考试B卷化学试卷(解析版) 题型:简答题
随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
(1)下图是在101 kPa,298K条件下1mol NO2和1mol CO反应生成1mol CO2和1mol NO过程中的能量变化示意图。
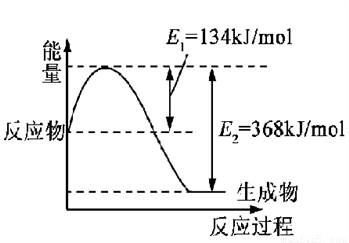
已知:① N2(g)+O2(g)=2NO(g) △H= +179.5kJ/mol
② 2NO(g)+O2(g)=2NO2(g) △H= -112.3kJ/mol
请写出NO与CO反应生成无污染气体的热化学方程式: ____________________
(2)将0.20 mol NO2和0.10 mol CO充入一个容积恒定为1L的密闭容器中发生反应,在不同条件下,反应过程中部分物质的浓度变化状况如下图所示。
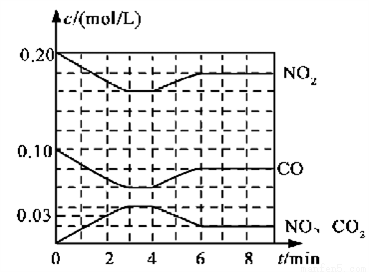
①下列说法正确的是___________(填序号)。
a.容器内的压强不发生变化说明该反应达到平衡
b.当向容器中再充入0.20 mol NO时,平衡向正反应方向移动,K增大
c.升高温度后,K减小,NO2的转化率减小
d.向该容器内充入He气,反应物的体积减小,浓度增大,所以反应速率增大
②计算产物NO在0~2 min内平均反应速率v(NO)=__________mol·L-1·min-1
③第4 min时改变的反应条件为__________________。
④计算反应在第6 min时的平衡常数K=________。若保持温度不变,此时再向容器中充入CO、NO各0.060 mol,平衡将________移动(填“正向”、“逆向”或“不”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com