
 实验室一瓶固体M的标签右半部分已被腐蚀,剩余部分只看到“Na2S”字样(如图所示).已知,固体M只可能是Na2SO3、Na2SiO3、Na2SO4中的一种.若取少量固体M配成稀溶液进行有关实验,下列说法错误的是
实验室一瓶固体M的标签右半部分已被腐蚀,剩余部分只看到“Na2S”字样(如图所示).已知,固体M只可能是Na2SO3、Na2SiO3、Na2SO4中的一种.若取少量固体M配成稀溶液进行有关实验,下列说法错误的是

科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
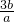
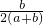

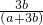
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
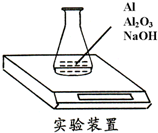 某种由Al与Al2O3粉末组成的混合物样品,利用如图装置测定混合物中Al的质量分数(已知样品质量为2.58g、锥形瓶和过量NaOH溶液的总质量为185.72g),每隔相同时间读得电子天平的数据如表:
某种由Al与Al2O3粉末组成的混合物样品,利用如图装置测定混合物中Al的质量分数(已知样品质量为2.58g、锥形瓶和过量NaOH溶液的总质量为185.72g),每隔相同时间读得电子天平的数据如表:| 读数次数 | 质量(g) | |
| 锥形瓶 + NaOH溶液 + 试样 | 第1次 | 188.30 |
| 第2次 | 188.28 | |
| 第3次 | 188.25 | |
| 第4次 | 188.24 | |
| 第5次 | 188.24 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com