
分析 (1)Cu元素的化合价升高,N元素的化合价降低,转移6e-;
(2)H的化合价降低,Zn的化合价升高;
(3)Cl元素的化合价由0升高为+1价,由0降低为-1价;
(4)反应过程中H2S中-2价的硫失去2个电子化合价升高到0价,所以H2S为还原剂,S为氧化产物;H2SO4(浓)中+6价的硫得到2个电子化合降低到SO2↑+中的+4价的硫,所以H2SO4(浓)为氧化剂,二氧化硫为还原产物,反应中转移2mol电子;
(5)Mn的化合价降低,O的化合价升高,所以KMnO4是氧化剂,KMnO4是还原剂,K2MnO4、MnO2是还原产物,O2是氧化产物,转移电子是4mol.
解答 解:(1)该反应中Cu元素化合价由0价变为+2价、Cu为还原剂,部分N元素化合价由+5价变为+2价,则HNO3为氧化剂,其得失电子最小公倍数是6,用双线桥标出该反应电子转移的方向和数目为 ,
,
故答案为: ;
;
(2)Zn+H2SO4═ZnSO4+H2↑中H的化合价降低,Zn的化合价升高,所以H2SO4是氧化剂,Zn是还原剂,ZnSO4是氧化产物,H2是还原产物,转移电子是2mol,电子转移情况如下: ,
,
故答案为: ;
;
(3)Cl元素的化合价由0升高为+1价,由0降低为-1价,该反应转移2e-,则用双线桥标出该反应电子转移的方向和数目为 ,
,
故答案为: ;
;
(4)反应过程中H2S中-2价的硫失去2个电子化合价升高到0价,所以H2S为还原剂,S为氧化产物;H2SO4(浓)中+6价的硫得到2个电子化合降低到SO2↑+中的+4价的硫,所以H2SO4(浓)为氧化剂,二氧化硫为还原产物,反应中转移2mol电子,所以用双线桥表示为
故答案为: ;
;
(5)2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑中Mn的化合价降低,O的化合价升高,所以KMnO4是氧化剂,KMnO4是还原剂,K2MnO4、MnO2是还原产物,O2是氧化产物,转移电子是4mol,电子转移情况如下: ,
,
故答案为: .
.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化及电子转移方向及数目的表示方法为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 10 mol•L-1 Na2SO4溶液中,粒子总数是0.83NA | |
| B. | 1 mol Fe3+完全水解,生成红氧化铁胶体位子的数目为NA | |
| C. | 常温常压下,16g O2和O3的混合气体中所含电子的数目为8NA | |
| D. | 标准状况下,分子数为NA的N2、C2H4混合气体的质量无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有1.25mol NaN3被氧化 | B. | 被还原的N原子的数目是0.2NA | ||
| C. | 转移电子的物质的量为2mol | D. | 标准状况下生成44.8L N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(Ac-)>c(OH-)>c(H+) | B. | c(Na+)=c(Ac-)>c(OH-)>c(H+) | ||
| C. | c(Na+)>c(OH-)>c(Ac-)>c(H+) | D. | c(Na+)>c(OH-)>c(H+)>c(Ac-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
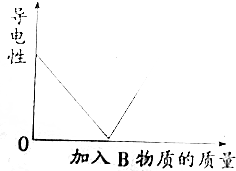 向某A溶液中加入一种物质B,其导电能力变化与加入B物质的质量关系符合如图曲线的是( )
向某A溶液中加入一种物质B,其导电能力变化与加入B物质的质量关系符合如图曲线的是( )| A. | 盐酸中滴加Ba(OH)2溶液至过量 | |
| B. | CaCl2溶液中滴加浓Na2CO3溶液至过量 | |
| C. | AgNO3溶液中滴加NaCl溶液至过量 | |
| D. | 稀硫酸中滴加Ba(OH)2溶液至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制备溴乙烷(C2H5Br)的装置和步骤如图:(已知溴乙烷的沸点38.4℃)
实验室制备溴乙烷(C2H5Br)的装置和步骤如图:(已知溴乙烷的沸点38.4℃)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| SiHCl3 | -126.5℃ | 33.0 | 易与水强烈反应,空气中易自然 |
| SiCl4 | -70 | 57.6 | 易水解 |
| HCl | -114.2 | -84.7 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 按要求完成下列问题.
按要求完成下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com