
【题目】将11.2g铜粉和镁粉的混合物分成两等份,其中一份加入200mL的稀硝酸中并加热,固体和硝酸恰好完全反应,并产生标准状况下的NO气体2.24L;将另一份在空气中充分加热,最后得到mg固体。下列有关说法:①c(HNO3)=2mol·L-l ②c(HNO3)=0.5mol·L-l ③m=8.0 ④m=7.2。其中正确的是( )
A.①④B.①③C.②④D.②③
【答案】B
【解析】
标况下2.24LNO的物质的量为:![]() =0.1mol,生成0.1molNO转移电子的物质的量为:0.1mol×(52)=0.3mol;铜和镁都是2价金属,根据电子守恒可知金属的物质的量为:
=0.1mol,生成0.1molNO转移电子的物质的量为:0.1mol×(52)=0.3mol;铜和镁都是2价金属,根据电子守恒可知金属的物质的量为:![]() =0.15mol,固体和硝酸恰好完全反应,反应生成硝酸铜、硝酸镁,根据N原子守恒,200mL该硝酸溶液中含有硝酸的物质的量为:0.15mol×2+0.1mol=0.4mol,该硝酸溶液的浓度为:
=0.15mol,固体和硝酸恰好完全反应,反应生成硝酸铜、硝酸镁,根据N原子守恒,200mL该硝酸溶液中含有硝酸的物质的量为:0.15mol×2+0.1mol=0.4mol,该硝酸溶液的浓度为:![]() =2mol/L,故①正确、②错误;
=2mol/L,故①正确、②错误;
铜与镁在空气中加热生成CuO、MgO,得到固体中含有氧元素的物质的量与金属的物质的量相等,则得到固体的质量为:![]() +16g/mol×0.15mol=8g,故③正确、④错误;
+16g/mol×0.15mol=8g,故③正确、④错误;
根据分析可知,正确的为①③,
答案选B。


科目:高中化学 来源: 题型:
【题目】某学生课外活动小组利用如图所示装置分别做如下实验:

(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则此溶液可能是__溶液;加热时溶液颜色变化的原因__。
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却恢复无色,则此溶液可能是__溶液;加热时溶液由无色变为红色的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu在加热条件下能与浓硫酸反应(反应Ⅰ),但工业上制取CuSO4却不是直接用浓硫酸与铜反应,而是将铜丝浸入稀硫酸中并不断由容器的下部吹入细小的空气泡(反应Ⅱ)。
(1)写出反应Ⅰ、Ⅱ的化学方程式___、___。
(2)试分析反应Ⅱ的制备办法的优点___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X。它们有如下的转化关系(部分产物及反应条件已略去):下列判断正确的是( )

A.X元素可能为Al
B.X元素一定为金属元素
C.反应①和②互为可逆反应
D.反应①和②一定为氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含Fe(NO3)3、Cu(NO3)2、HNO3的某稀溶液,若向其中逐步加入铁粉,溶液中Fe2+浓度与加入铁粉的物质的量之间的关系如右图所示,则该溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )

A. 1∶1∶3B. 1∶2∶4C. 1∶1∶4D. 1∶3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气明朝《天工开物》中有世界上最早的“火法”炼锌技术的记载,锌是生命体必需的微量元素,被称为“生命之花”。(已知阿伏加德罗常数的值为NA)
(1)基态![]() 原子核外的最高能层符号是________,基态
原子核外的最高能层符号是________,基态![]() 最外层电子排布式为________。
最外层电子排布式为________。
(2)乳酸锌[ ]是一种很好的食品锌强化剂,其中存在的作用力有________(填编号)。
]是一种很好的食品锌强化剂,其中存在的作用力有________(填编号)。![]() 乳酸锌中含有________个σ键。
乳酸锌中含有________个σ键。
A.离子键 B.极性共价键 C.金属键 D.配位键 E.范德华力
(3)一水合甘氨酸锌是一种矿物类饲料添加剂,结构简式如图所示。其中所涉及的非金属元素的电负性由大到小的顺序是________,![]() 分子的空间构型为________形,
分子的空间构型为________形,![]() 的配位数为________。甘氨酸(
的配位数为________。甘氨酸(![]() )中N原子的杂化轨道类型为________;甘氨酸易溶于水,试从结构角度解释________。
)中N原子的杂化轨道类型为________;甘氨酸易溶于水,试从结构角度解释________。
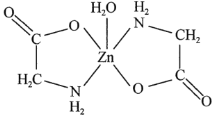
(4)Zn与S形成某种化合物的晶胞如图所示。

![]()
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。例如图中原子1的坐标为![]() ,则原子2的坐标为________。
,则原子2的坐标为________。
②已知晶体密度为![]() ,
,![]() 半径为
半径为![]() ,若要使
,若要使![]() 、
、![]() 相切,则
相切,则![]() 半径为________
半径为________![]() (写计算表达式)。
(写计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气中硫、氮的氧化物是形成酸雨的主要物质。某地酸雨中可能含有下列离子:Na+、Ba2+、NH4+、Al3+、Cl-、SO32-、SO42-、NO3-等。某研究小组取该地一定量的酸雨,浓缩后将所得澄清试液分成三份,进行如下实验:
试样 | 所加试剂 | 实验现象 |
第一份试液 | 滴加适量的淀粉KI溶液 | 溶液呈蓝色 |
第二份试液 | 滴加用盐酸酸化的BaCl2溶液 | 有白色沉淀产生 |
第三份试液 | 滴加NaOH溶液,加热,加入的NaOH溶液体积(V)与生成的沉淀、产生的气体的物质的量(n)的关系如图 |
|
请回答下列问题:
(1)根据实验结果判断该酸雨中肯定不存在的离子是____,不能确定的离子有___。
(2)写出第一份试液滴加淀粉KI溶液时发生反应的离子方程式:____。
(3)第三份试液滴加NaOH溶液,加热,整个过程中发生了多个反应,写出其中两个反应的离子方程式:
①最初发生的离子反应____。
②最后发生的离子反应____。
(4)该小组为了探究NO参与硫酸型酸雨的形成过程,在烧瓶中充入含有少量NO的SO2气体,再慢慢通入O2,发生化学反应后,再喷洒适量蒸馏水即得硫酸型酸雨,则NO在上述反应中的作用是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示。分别滴加NaOH溶液(c=0.1 mol·L-1)至pH=7。消耗NaOH溶液的体积为Vx、Vy则( )
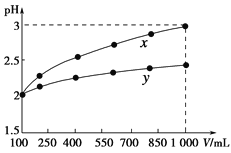
A.x为弱酸,Vx<VyB.x为强酸,Vx>Vy
C.y为弱酸,Vx<VyD.y为强酸,Vx>Vy
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是( )
A. ![]() mol·L-1B.
mol·L-1B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1D.
mol·L-1D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com