
下列指定反应的离子方程式正确的是
A. 用醋酸除去水垢中的碳酸钙:CaCO3+2H+ =Ca2++H2O+CO2↑
B. 硫化钠水溶液呈碱性的原因:S2-+2H2O H2S↑+2OH-
H2S↑+2OH-
C. 向NaHCO3溶液中加入少量的Ba(OH)2溶液:Ba2++OH- +HCO3- = BaCO3↓+ 2H2O
D. 向Na2FeO4溶液中加入稀硫酸产生氧气: 4FeO42-+20H+=4Fe3++3O2↑+10H2O
科目:高中化学 来源:2016-2017学年浙江省台州市高二上学期期末质量评估考试化学试卷(解析版) 题型:选择题
下列叙述正确的是( )
A. 强电解质都易溶于水,所以BaSO4是弱电解质
B. 氨气的水溶液可以导电,但氨气属于非电解质
C. 使用催化剂可以让不自发的化学反应自发进行
D. 电解质溶液的导电过程属于物理变化
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省宿州市高一上学期期末教学质量检测(a卷)化学试卷(解析版) 题型:选择题
只用一种试剂就可将AgNO3、KSCN和H2SO4、NaOH四种无色溶液区分,这种试剂是
A. Fe(NO3)3溶液 B. MgC12溶液 C. BaC12溶液 D. FeC13溶液
查看答案和解析>>
科目:高中化学 来源:2017届江苏省联盟大联考高三2月联考化学试卷(解析版) 题型:推断题
维拉佐酮是临床上使用广泛的抗抑郁药,其关键中间体的合成路线如下:

(1)D中的含氧官能团名称为____________(任写2种)。
(2)B C的反应类型为__________________。
C的反应类型为__________________。
(3)化合物E的结构简式为___________________。
(4)写出同时满足下列条件的B的一种同分异构体的结构简式:______________。
①能发生银镜反应;
②能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应;
③分子中有3种不同化学环境的氢。
(5)已知:RBr RCN
RCN RCOOH。请以甲苯和乙醇为原料制备
RCOOH。请以甲苯和乙醇为原料制备 ,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干):____________________________。
,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干):____________________________。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省联盟大联考高三2月联考化学试卷(解析版) 题型:选择题
某兴趣小组用电化学法模拟工业处理SO2。将硫酸工业尾气中的SO2通入右图装置(电极均为惰性材料)进行实验。下列说法正确的是

A. N极为负极
B. 反应一段时间后,左侧电解质溶液的pH增大
C. M极发生的电极反应为SO2+2H2O-2e-=SO42-+4H+
D. 在相同条件下,M、N两极上消耗的气体体积之比为1:2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省六校协作体高一下学期期初化学试卷(解析版) 题型:简答题
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元
素的含量。实验步骤如下:
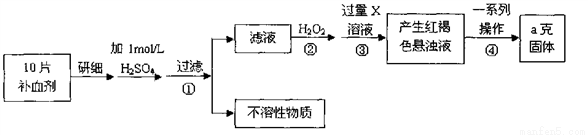
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法________________________________,该
过程的现象为:______________________________
(2)步骤②加入过量H2O2的目的(用离子方程式表示):_______________。
(3)步骤③中反应的离子方程式:_______________________________________。
(4)实际上向滤液中直接滴加X溶液最终也会生成红褐色浊液,此过程中发生的
氧化还原反应为(用化学方程式表达)_________________________。
(5)步骤④中最终得到a克红棕色粉末,则一系列处理的操作步骤:_________、
洗涤、_________、冷却、称量。
(6)若实验无损耗,则每片补血剂含铁元素的质量__________g。
(7)正常人每天应补充14mg左右的铁,如果全部通过服用含FeSO4·7H2O的片剂
来补充铁,则正常人每天服需用含______________mgFeSO4·7H2O的片剂。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省六校协作体高一下学期期初化学试卷(解析版) 题型:选择题
在硫酸铝、硫酸钾和明矾[KAl(SO4)2·12H2O]的混合溶液中,SO42—的浓度为0.3mol/L,当加入等体积0.4mol/L KOH溶液时,生成的沉淀恰好完全溶解。则反应后溶液中K+的浓度约为
A. 0.225mol/L B. 0.25mol/L C. 0.35mol/L D. 0.7mol/L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市高二上学期期末考试化学试卷(解析版) 题型:简答题
短周期元素A、B、C、D、E原子序数依次增大。A是周期表中原子半径最小的元素,B原子的价电子数等于该元素最低化合价的绝对值,C与D能形成D2C和D2C2两种化合物,而D是同周期中金属性最强的元素,E的负一价离子与C和A形成的某种化合物分子含有相同的电子数。
(1)A、C、D形成的化合物中含有的化学键类型为_______________。
(2)已知:①E-E→2E·;△H=+a kJ·mol-1
② 2A·→A-A;△H=-b kJ·mol-1
③E·+A·→A-E;△H=-c kJ·mol-1(“·”表示形成共价键所提供的电子)
写出298K时,A2与E2反应的热化学方程式____________________________________。
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g) X(g);△H=-dJ·mol-1(d>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
X(g);△H=-dJ·mol-1(d>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
实验 | 甲 | 乙 | 丙 |
初始投料 | 2 molA2、1 molBC | 1 molX | 4 molA2、2 molBC |
平衡时n(X) | 0.5mol | n2 | n3 |
反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
体系的压强 | P1 | P2 | P3 |
反应物的转化率 | α1 | α2 | α3 |
①在该温度下,假设甲容器从反应开始到平衡所需时间为4 min,则该时间段内A2的平均反应速率v(A2)________。
②该温度下此反应的平衡常数K的值为___________。
③三个容器中的反应分别达平衡时各组数据关系正确的是_______(填序号)。
A.α1+α2=1 B.Q1+Q2=d C.α3<α1
D.P3<2P1=2P2 E.n2<n3<1.0mol F.Q3=2Q1
④在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡时A2的总转化率为65.5%,请在下图中画出第5min 到新平衡时X的物质的量浓度的变化曲线。_______
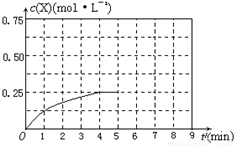
查看答案和解析>>
科目:高中化学 来源:河北省2016-2017学年高一下学期开学考试化学试卷 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述错误的是
A. 含14g硅原子的二氧化硅晶体中含有的硅氧键数目为2NA
B. 3.9g Na2O2晶体中含有0.2NA个离子
C. 常温常压下,5g D2O含有的质子数、电子数、中子数均为2.5NA
D. 3mol H2和1mol N2在一定条件下反应所得混合气体分子数大于2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com