
����Ŀ�����ᶡ�����������������
���� | 1-���� | ���ᶡ�� | |
�۵�(��) | 16.6 | ��89.5 | ��73.5 |
�е�(��) | 117.9 | 117 | 126.3 |
�ܶ�(g/cm3) | 1.05 | 0.81 | 0.88 |
ˮ���� | ���� | ����(9g/100gˮ) | �� |
ʵ��������ͼ��ʾ��ʵ��װ����ȡ���ᶡ����
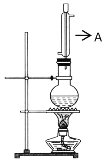
(1)����A������___��
(2)д����ȡ���ᶡ���Ļ�ѧ����ʽ��__��
(3)��ʵ����������������������ᶡ���⣬���������ɵ��л���������__(д��һ�ֽṹ��ʽ)��
(4)������Ӧ��һ�����淴Ӧ��Ϊ���1-������ת���ʣ��ɲ�ȡ�Ĵ�ʩ��__(д������)��
(5)���Ʊ����ᶡ�����õĻ�����з��롢�ᴿ���ᶡ��ʱ����Ҫ�����ಽ����������ͼʾ�IJ����У���Ҫ����__(��𰸱��)��
(6)��60g������37g1-������Ӧ��ʵ���еõ����ᶡ��������Ϊ40.6g�������ᶡ���IJ���Ϊ___��
���𰸡�ֱ�������� CH3COOH��HOCH2CH2CH2CH3![]() CH3COOCH2CH2CH2CH3��H2O CH3CH2CH2CH2OCH2CH2CH2CH3��CH3CH2CH=CH2 ����������������С������Ũ��(������������) AB 70%
CH3COOCH2CH2CH2CH3��H2O CH3CH2CH2CH2OCH2CH2CH2CH3��CH3CH2CH=CH2 ����������������С������Ũ��(������������) AB 70%
��������
�����1-������Ũ������������·���������Ӧ�������ᶡ�����Ʊ����ᶡ�������У���Ũ���������£�1-�����ܹ�������ȥ��Ӧ����1-��ϩ���ܹ�������������ˮ���������ѣ�����������������Ӧ�ǿ��淴Ӧ������Ӱ�컯ѧƽ������ؽ��н�����1-����ת���ʣ�����������һ�ַ�Ӧ��Ũ�Ȼ�����������Ũ�ȣ��ᴿ���������ᶡ��ʱ����Ҫͨ����Һ���������ᶡ���IJ���=![]() ��100%���ݴ˷������
��100%���ݴ˷������
(1)����A������ֱ�������ܣ�
(2)�����1-������Ũ������������·���������Ӧ�������ᶡ������ȡ���ᶡ���Ļ�ѧ����ʽ��CH3COOH��HOCH2CH2CH2CH3![]() CH3COOCH2CH2CH2CH3��H2O��
CH3COOCH2CH2CH2CH3��H2O��
(3)���ݷ������Ʊ����ᶡ�������У���Ũ���������£�1-�����ܹ�������ȥ��Ӧ����1-��ϩ���ܹ�������������ˮ���������ѣ����л���������ܵĽṹ��ʽΪCH3CH2CH2CH2OCH2CH2CH2CH3��CH3CH2CH=CH2��
(4)������Ӧ��һ�����淴Ӧ���ӻ�ѧƽ���ƶ��ĽǶȷ�����֪�����������������С������Ũ��(������������)����ʹƽ�����ƣ����������1-�����������ʣ�
(5)���Ʊ����ᶡ�����õĻ�����з��롢�ᴿ���ᶡ��ʱ����Ҫ�������뾭����ȡ���Һ����ѡAB��
(6)60g��������ʵ���Ϊ![]() =1mol��37g1-���������ʵ���Ϊ
=1mol��37g1-���������ʵ���Ϊ![]() =0.5mol�����ݷ�ӦCH3COOH��HOCH2CH2CH2CH3
=0.5mol�����ݷ�ӦCH3COOH��HOCH2CH2CH2CH3![]() CH3COOCH2CH2CH2CH3��H2O��֪�������������1-�����������㣬0.5mol��1-������ȫ��Ӧʱ�������ᶡ�������ʵ���Ϊ0.5mol���������������ᶡ��������Ϊ0.5mol��116g/mol=58g��ʵ���еõ����ᶡ��������Ϊ40.6g�������ᶡ���IJ���=
CH3COOCH2CH2CH2CH3��H2O��֪�������������1-�����������㣬0.5mol��1-������ȫ��Ӧʱ�������ᶡ�������ʵ���Ϊ0.5mol���������������ᶡ��������Ϊ0.5mol��116g/mol=58g��ʵ���еõ����ᶡ��������Ϊ40.6g�������ᶡ���IJ���=![]() ��100%=
��100%=![]() ��100%=70%��
��100%=70%��


 �㽭��У��ʦ���ϵ�д�
�㽭��У��ʦ���ϵ�д� ȫ�ų��100��ϵ�д�
ȫ�ų��100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)ȡ300 mL 0.2 mol/L�� KI��Һ��һ���������� KMnO4 ��Һǡ�÷�Ӧ�����ɵ����ʵ����� I2�� KIO3�������� KMnO4�����ʵ�����___mol��
(2)�� Fe(NO3)3 ��Һ�м��� Na2SO3 ��Һ����Һ�����ػ�ɫ��Ϊdz��ɫ����һ���ֱ�Ϊ�ػ�ɫ����Һ�ȱ�Ϊdz��ɫ�����ӷ���ʽ��___���ֱ�Ϊ�ػ�ɫ��ԭ����(�����ӷ���ʽ����)____��
(3)�� 100 mLFeBr2 ��Һ��ͨ���״����3.36 L Cl2����Һ����![]() �� Br -�������ɵ��� Br2����ԭ FeBr2��Һ�� FeBr2 �����ʵ���Ũ��Ϊ_____mol/L��
�� Br -�������ɵ��� Br2����ԭ FeBr2��Һ�� FeBr2 �����ʵ���Ũ��Ϊ_____mol/L��
(4)��������(NF3)��һ����ɫ����ζ�����壬�������ӹ�ҵ�����Ĺؼ�ԭ��֮һ�����������ڳ�ʪ�Ŀ�������ˮ�����ܷ���������ԭ��Ӧ���䷴Ӧ�IJ����У�HF��NO��HNO3��
��д���÷�Ӧ�Ļ�ѧ����ʽ____��
��NF3��ɫ��������һ���ڿ�����й©���������ڷ��֣��жϸ�����й©ʱ��������___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ������������⣺
(1)�о����֣���CO2��ѹ�ϳɼ״���Ӧ(CO2��3H2 === CH3OH��H2O)�У�Co�����︺�ص�Mn�������������Ӵ������и��ԣ���ʾ�����õ�Ӧ��ǰ�����ش��������⣺
Co��̬ԭ�Ӻ�������Ų�ʽΪ________��Ԫ��Mn��O�У���һ�����ܽϴ����_____����̬ԭ�Ӻ���δ�ɶԵ������϶����________��
(2)�ҹ���ѧ������ɹ��ϳ������������嵪��������(N5)6(H3O)3(NH4)4Cl(��R����)��
�ش��������⣺
�ٵ�ԭ�ӵļ۵����Ų�ͼΪ_________��
��Ԫ�صĻ�̬��̬ԭ�ӵõ�һ�������γ���̬��һ������ʱ���ų�������������һ��������(E1)���ڶ����ڲ���Ԫ�ص�E1�仯������ͼ��ʾ�����г���Ԫ���⣬����Ԫ�ص�E1����������������ԭ����________����Ԫ�ص�E1�����쳣��ԭ����_______��
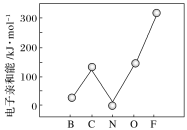
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȩ�������ϰ�������ĵ�һ���ȵ����⣬��ȩ�Ѿ�������������֯�϶�Ϊһ���°���ҹ���ѧ�����Ƴ�һ�ִ��������������¸�Ч�������м�ȩ���������䷴Ӧ���£�HCHO+O2![]() CO2+H2O�������й�˵����ȷ���ǣ� ��
CO2+H2O�������й�˵����ȷ���ǣ� ��
A.��Ӧ��������ﶼ��������
B.0.5molHCHO����1mol����
C.HCHO��CO2����ԭ���ӻ�������ͬ
D.HCHO���ܽ���H2O��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(��Ҫ�ɷ��ǵ���)Ϊԭ���Ʊ��Ҵ����������£�

����˵��������ȷ����
A. C12H22O11���ڶ���B. �ɲ�ȡ��Һ�ķ��������Ҵ���ˮ
C. ���õ�ˮ��������Ƿ���ȫˮ��D. �����ǿ����ھ���ø�����·ֽ������Ҵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Īɳ������һ����ʹҩ�����ĺϳ�·�����£�
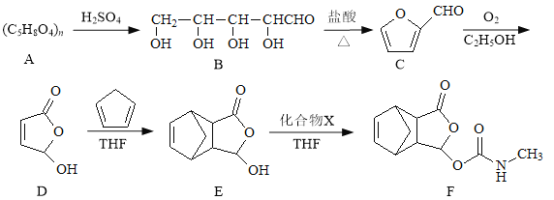
(1)B������̼ԭ����Ϊ_________________��������C�����������ŵ�����Ϊ_________________��
(2)����˵����ȷ����_________________��
A��B����������ͬϵ���ϵ
B��A��B��ˮ�ⷴӦ
C��E���Է�����ȥ��Ӧ��F����HC1��Ӧ
(3)C��������Һ��Ӧ�Ļ�ѧ����ʽΪ_________________��
(4)д��ͬʱ��������������E��ͬ���칹������һ�ֽṹ��ʽ:_________________��
I.�˴Ź���������4���壻
��.�ܷ���������Ӧ��ˮ�ⷴӦ��
��.����FeCl3��Һ������ɫ��Ӧ��
(5)��֪E+X��FΪ�ӳɷ�Ӧ��������X�Ľṹ��ʽΪ_________________��
(6)��֪: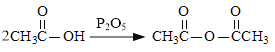 ��������
��������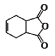 �Ǻϳɿ�����ҩ������Τ���м��壬����
�Ǻϳɿ�����ҩ������Τ���м��壬����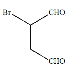 ��
��![]() Ϊԭ�Ϻϳɸû�����밴Ҫ���������ת������:
Ϊԭ�Ϻϳɸû�����밴Ҫ���������ת������: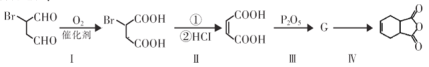
����I���ķ�Ӧ����_________________��
�����������������ķ�Ӧ����_________________��
����������G�Ľṹ��ʽ_________________��
���������Ļ�ѧ����ʽ_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣��������е���ĸ�ֱ����һ��Ԫ�ء�
A | R | |||||||||||||||||
B | C | D | E | F | T | |||||||||||||
G | H | I | J | K | L | |||||||||||||
M | N | O | ||||||||||||||||
�Իش���������(ע�⣺ÿ���е���ĸ����Ϊ�ϱ��е���ĸ���ţ�����ΪԪ�ط���)
(1)N�ĵ��ʺ�ˮ������Ӧ�����ɹ���X����I�ĵ�����X�����·�Ӧ�Ļ�ѧ����ʽ______��
(2)D�ļ���̬�⻯���VSEPRģ�͵�����Ϊ______��
(3)��A��C��D�γɵ�ACD�����У���������������=______��
(4)Ԫ��M�Ļ�����(ME2L2)���л��ϳ��п������������Ȼ��������������л��ﷴӦ���ش����⣺
��ME2L2������Ϊ���ɫҺ�壬����CCl4��CS2�Ȼ��ܣ��ݴ˿��ж�ME2L2��______(���������������Ǽ�����)���ӡ�
�ڽ�N��O�ĵ����õ������Ӻ����D������������Ӧ��ˮ����Ũ��Һ�У����Ƴ�ԭ��أ�����ɸ������ϵ�Ԫ�ص���Χ���ӹ����ʾʽΪ______��
(5)��ͼ�������߷ֱ��ʾ��A�塢��/span>A�塢��A�塢��A��Ԫ����̬�⻯��е�仯����E���⻯�����ڵ�������______(��m��n��x��y)��
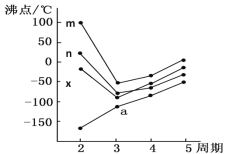
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�к���80����Ԫ�أ�����Ҫ��������Դ���⣬ͬʱ��ˮ����ǿ�����Ȼ����������Ϊ���������Ⱦ�����ṩ�˹����Ŀռ䡣
��1������֪��ͬpH�����£�ˮ��Һ��̼Ԫ�صĴ�����̬����ͼ��ʾ������˵������ȷ����______________������ĸ��ţ���

a��pH=8ʱ����Һ�к�̼Ԫ�ص�����Ҫ��HCO3-
b��A�㣬��Һ��H2CO3��HCO3-Ũ����ͬ
c����c(HCO3-)=c(CO32-)ʱ��c(H+)>c(OH -)
��������pH=8.4��ˮ��Һ�м���NaOH��Һʱ������Ӧ�����ӷ���ʽ��______________��
(2)��ˮpH�ȶ���7.9��8.4֮�䣬�������̵�����CO2��SO2�����ռ���
�ٺ�ˮ�к��е�OH -���������̵����е�CO2ͬʱΪ��ˮ�Ѹƣ�����CaCO3��д���˷�Ӧ�����ӷ���ʽ��__________��
����֪��25��ʱ��H2CO3����ƽ�ⳣ��K1=4.3��10-7 K2=5.6��10 -11
H2SO3����ƽ�ⳣ��K1=1.5��10-2 K2 =6.0��10-8
��ˮ�к��е�HCO3-����������SO2���ù��̵����ӷ���ʽ��_______________��
(3)ϴ��������ĺ�ˮ�����ԣ��账���������ŷš������ʺ�ˮ���ͬʱ������������ų�����CO2����һ�ִ�������Ч��ʽ��
��ͨ��O2�ɽ����Ժ�ˮ�е���(IV)�������÷�Ӧ�����ӷ���ʽ��_______________��
��������ʽʹ������ˮpH���ߵ�ԭ����_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.10mol/L CH3 COOH��Һ�ζ�10.00mLŨ�Ⱦ�Ϊ0.10 mol/L NaOH��NH3��H2O�Ļ��Һ�������Һ����Ե����������������ı仯��������ͼ��ʾ����֪��Ka(CH3COOH)=1. 8��10-5��Kb( NH3��H2O) =1. 8�� l0-5�����������������
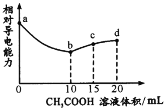
A.ab��ΪCH3COOH��NaOH���к���
B.b��ˮ�ĵ���̶����
C.c��3c(Na+)=2c(CH3 COOH)+2c(CH3 COO-)
D.d��c(Na+)��c(NH![]() )��c(OH-)��c(H+)
)��c(OH-)��c(H+)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com