
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+。现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( )

A.图中AB段的氧化剂为K2Cr2O7
B.图中BC段发生的反应为2Fe3++2I-=2Fe2++I2
C.开始加入的K2Cr2O7为0.15 mol
D.K2Cr2O7与FeSO4反应的物质的量之比为1∶6
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2017届天津市高三上质量调查二化学卷(解析版) 题型:选择题
取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有200 mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol/L的NaOH溶液, 产生沉淀的量与所加NaOH溶液的体积的关系如下图所示。则原H2SO4物质的量浓度是( )

A.1mol/L B.2mol/L C.3mol/L D.4mol/L
查看答案和解析>>
科目:高中化学 来源:2017届四川省泸州市高三上10月月考化学卷(解析版) 题型:选择题
研究人员发现了一种“水”电池,其总反应为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl。如图用“水”电池为电源电解NaCl溶液的实验中,X电极上有无色气体逸出。下列有关分析正确的是( )
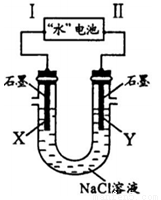
A.I为负极,其电极反应式为Ag+Cl-+e-=AgCl
B.“水”电池内Na+不断向负极作定向移动
C.每转移1mole-,U型管中消耗0.5molH2O
D.“水”电池内,每生成1molNa2Mn5O10,X电极上生成1mol气体
查看答案和解析>>
科目:高中化学 来源:2017届山西省大同市高三上学期第一次调研化学试卷(解析版) 题型:选择题
下列化学符号正确的是( )
A.二氧化硅的结构式O=Si=O
B.聚乙烯的结构简式
C.过氧化钠的电子式
D.羟基的电子式
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上学期10月质检化学试卷(解析版) 题型:选择题
从下列事实所列出的相应结论正确的是( )
实 验 事 实 | 结 论 | |
① | SO2使酸性高锰酸钾溶液退色 | 可证明SO2有漂白性 |
② | 用磨口玻璃瓶保存NaOH溶液,用热的纯碱溶液清洗容器里附 | 都发生了氧化还原反应 |
③ | 取少量Na2SO3样品加入Ba(NO3)2溶液后,产生白色沉淀滴加稀盐酸,沉淀不溶解, | 证明Na2SO3已氧化变质 |
④ | 某溶液加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体,该溶液滴加CaCl2溶液,有白色沉淀生成 | 确定该溶液存在CO32- |
⑤ | 某无色溶液中加入浓氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该溶液一定有NH4+ |
A.①② B.③④ ⑤ C. ②④ D.④ ⑤
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上学期10月质检化学试卷(解析版) 题型:选择题
下列叙述正确的是( )
①一束平行光线照射蛋白质溶液时,从侧面可看到光亮的通路
②一定温度和压强下,气体体积主要由其分子的物质的量决定
③气体摩尔体积是指单位物质的量的气体所占的体积,其单位是L
④同温同压下,气体的密度与气体的相对分子质量成正比
⑤在同温同体积时,气体的物质的量越大,则压强越大
⑥蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
⑦标准状况下,将lg铝片投入20mL 18mol/L的硫酸中,铝片完全溶解
A.①⑤⑥⑦ B.①②④⑤ C.①②⑥⑦ D.②③④⑤
查看答案和解析>>
科目:高中化学 来源:2017届山东省栖霞市高三上学期期中化学试卷(解析版) 题型:实验题
过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。实验室可用工业碳酸钙(含MgCO3、FeCO3等杂质)制取纯净的碳酸钙,然后再用纯的碳酸钙制取过氧化钙,其主要流程如下:

已知:CaO2·8H2O呈白色微溶于水,加热至350℃左右开始分解放出氧气,425℃分解完全。
(1)写出反应①屮氧化还原反应的离子方程式___________________。
(2)向反应①后的溶液中加浓氨水的目的是_________________。
(3)写出反应②的化学方程式_________________;反应②常用冰水控制温度在0℃左右.其可能原因是(写出两种):
①________________;②________________。
(4)测定产品中CaO2的含量的实验步骤是
第一步:准确称取a g产品于有塞锥形瓶中,加人适量蒸馏水和过量的b gKI晶体,再滴人少量2 mol • L-1H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加人几滴淀粉溶液。
第三步:逐滴加入浓度为c mol • L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液VmL。已知:I2+2S2O32- =2I-+S4O62-。
某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能__________(填“不受影响”“偏低”或“偏高”),原因是________________。
查看答案和解析>>
科目:高中化学 来源:2017届山东省栖霞市高三上学期期中化学试卷(解析版) 题型:选择题
下列叙述正确的是
A. 硫离子的结构示意图为
B. 核外电子排布相同的微粒化学性质也相同
C. 氢弹中用到的2H、3H互为同位素
D. 同种元素的原子均有相同的质子数和中子数
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省宁德市高二上期中化学试卷(解析版) 题型:实验题
全世界每年被腐蚀损耗的钢铁材料约占全年钢铁产量的十分之一。研究钢铁的腐蚀及防护有重要意义。回答下列问题:
(1)钢铁发生腐蚀的主要类型是电化学腐蚀,在电化学腐蚀中,负极反应是_____________,正极反应是_____________。
(2)某实验小组设计下列实验探究铁生锈的条件:

反应4 min后观察,发现A处铁丝依然光亮,B处铁丝表面灰暗,D处铁丝依然光亮。该实验说明铁生锈主要与_________和___________有关;B、D处实验现象对比说明:决定铁生锈的一个重要因素是___________。
(3)金属及塑料制品表面镀铬不仅美观还可提高金属制品抗腐蚀性能。常见镀铬液由重铬酸(H2Cr2O7)和催化剂硫酸组成。
①重铬酸中,Cr元素的化合价为________。
②镀铬时由CrO42-放电产生铬镀层。阴极的电极反应式为_______。
(4)电镀废水中Cr2O72-具有高毒性,必须经处理后才能排放。电解法处理含铬的强酸性废水的原理如右图所示。

电解产生的Fe2+将Cr2O72-还原为Cr3+,再随着溶液pH的升高,便有Fe(OH)3和Cr(OH)3沉淀生成。
①图中A为电源__________极;电解时阴极产生的气体为____________(写化学式)。
②写出Fe2+与Cr2O72-反应的离子方程式:_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com