
科目:高中化学 来源: 题型:阅读理解
| ||

| pH | C(CrO42-)mol/L | C(HCrO4-)mol/L | C(Cr2O72-)mol/L | C(H2CrO4)mol/L |
| 4 | 0.0003 | 0.104 | 0.448 | 0 |
| 5 | 0.0033 | 0.103 | 0.447 | 0 |
| 6 | 0.0319 | 0.0999 | 0.437 | 0 |
| 7 | 0.2745 | 0.086 | 0.3195 | 0 |
| 8 | 0.902 | 0.0282 | 0.0347 | 0 |
| 9 | 0.996 | 0.0031 | 0.0004 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)
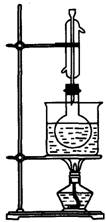 实验室制备少量的碘乙烷:将红磷粉末放入乙醇里,在不断振荡下逐次加入细粒的I2,则有反应:2P+3I2→2PI3 …………
实验室制备少量的碘乙烷:将红磷粉末放入乙醇里,在不断振荡下逐次加入细粒的I2,则有反应:2P+3I2→2PI3 …………
待反应缓和后,用右图装置进行水浴加热,半小时后反应可基本完成,这时反应液中已基本无固体颗粒I2和红磷,然后要加入一些物质X,并将竖直的冷凝管更换为横放的冷凝管,水浴加热,蒸馏出粗品碘乙烷,此粗品中溶有乙醇和碘(纯净的碘乙烷为无色不溶于水的液体,沸点72.3℃),请回答下列问题:
1.写出由PI3制备碘乙烷的主反应和副反应。
2.X可能是什么物质?为什么要加入X?
3.图中的竖直冷凝管起什么作用?如何通冷凝水?
4.怎样除去粗品中的乙醇和碘?(指出加入的试剂和有关操作的名称)
查看答案和解析>>
科目:高中化学 来源:2009年广东省梅州中学高考化学模拟试卷(解析版) 题型:解答题
 12Na2CrO4+3Fe2O3+7KCl+12H2O
12Na2CrO4+3Fe2O3+7KCl+12H2O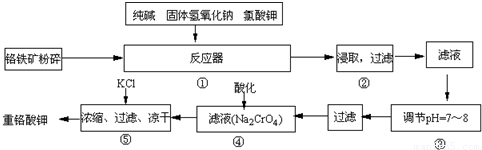
| pH | C(CrO42-)mol/L | C(HCrO4-)mol/L | C(Cr2O72-)mol/L | C(H2CrO4)mol/L |
| 4 | 0.0003 | 0.104 | 0.448 | |
| 5 | 0.0033 | 0.103 | 0.447 | |
| 6 | 0.0319 | 0.0999 | 0.437 | |
| 7 | 0.2745 | 0.086 | 0.3195 | |
| 8 | 0.902 | 0.0282 | 0.0347 | |
| 9 | 0.996 | 0.0031 | 0.0004 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com