
【题目】下列事实中,不能用勒夏特列原理解释的是( )
A.冰镇的啤酒打开后泛起泡沫
B.对N2+3H2![]() 2NH3的反应,使用铁触媒可加快合成氨反应的速率
2NH3的反应,使用铁触媒可加快合成氨反应的速率
C.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
D.工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述不正确的是
A.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
B.与![]() 互为同分异构体的芳香化合物有6种
互为同分异构体的芳香化合物有6种
C.C5H12的一氯代物有8种
D.菲的结构简式为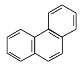 ,它与硝酸反应,可生成5种一硝基取代物
,它与硝酸反应,可生成5种一硝基取代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.熔点:锂<钠<钾<铷<铯
B.由于HCl的分子间作用力比HI的强,故HC1比HI稳定
C.等质量的金刚石和石墨晶体所含碳碳键的数目相等
D.已知离子晶体AB的晶胞如图所示,则每个A+周围距离最近且等距的B-有8个
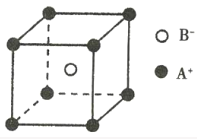
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)油酸的化学式为![]() ,其结构中含有
,其结构中含有![]() 、和
、和![]() 两种官能团,则通过实验检验
两种官能团,则通过实验检验![]() 的方法是__________;通过实验检验
的方法是__________;通过实验检验![]() 的方法是______。
的方法是______。
(2)![]() 某种油脂发生氢化反应,需标准状况下氢气的体积为
某种油脂发生氢化反应,需标准状况下氢气的体积为![]() ;等物质的量的该油脂氢化后,再发生皂化反应共消耗
;等物质的量的该油脂氢化后,再发生皂化反应共消耗![]() 。若该油脂是简单甘油酯,则它的结构可表示为______。
。若该油脂是简单甘油酯,则它的结构可表示为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W 均为短周期元素 , 它们在周期表中相对位置如图所示。若Z原子的最外层电子数是K层电子数的3倍, 下列说法中正确的是
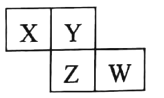
A.最高价氧化物对应水化物的酸性Z比W强
B.只由这四种元素不能组成有机化合物
C.与Z的单质相比较,Y的单质不易与氢气反应
D.X、Y形成的化合物都是无色气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉铜矿主要成分为Cu2S,软锰矿主要成分为MnO2,它们都含有少量 SiO2、Fe2O3等杂质。工业上综合利用这两种矿物制备碳酸锰和硝酸铜晶体的主要工艺流程如图所示 :

已知:①部分金属阳离子生成氢氧化物沉淀的 pH范围如下表所示(开始沉淀的pH 按金属离子浓度为 0. l mol/L 计算)
开始沉淀的 pH | 沉淀完全的pH | |
Fe3+ | 1.1 | 3.2 |
Mn2+ | 8.3 | 9.8 |
Cu2+ | 4.4 | 6.4 |
②100.8≈6.3
(1)酸浸时,下列措施能够提高浸取速率的措施是__________________ 。
A.将矿石粉碎 B.适当延长酸浸时间 C.适当升高温度
(2)酸浸时, MnO2 与Cu2S反应的离子方程式是 __________________。
(3)浸出液调节pH = 4 的目的是_____________________ ,浸出液中铜离子浓度最大不能超过_______________ molL-1(保留一位小数)。
(4)生成 MnCO3 沉淀的离子方程式是_______________________。
(5)本工艺中可循环使用的物质是 ___________________(写化学式)。
(6)流程中需要加入过量HNO3溶液,除了使 Cu2(OH)2CO3完全溶解外,另一作用是蒸发结晶时_______________________。
(7)制得的Cu(NO3)2 晶体需要进一步纯化, 其实验操作名称是______________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物广泛存在于自然界。随着科技的进步,利用化学反应原理将含碳物质进行合理转化,已成为资源利用、环境保护等社会关注问题的焦点。如CO2是人类工业生产排放的主要的温室气体,利用CO2制造更高价值化学品是目前的研究热点。
(1)①利用CH4和CO2这两种温室气体可以生产水煤气。已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H =![]() 890.3 kJ·mol-1
890.3 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H =+2.8 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H =![]() 566.0 kJ·mol-1
566.0 kJ·mol-1
反应CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g) 的△H =____kJ·mol-1
2CO(g)+2H2(g) 的△H =____kJ·mol-1
②250℃时,以镍合金为催化剂,向4 L恒容容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2 (g)+CH4(g) ![]() 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
物质 | CH4 | CO2 | CO | H2 |
体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
此温度下该反应的平衡常数K=_______。
(2)利用CO2催化加氢可以合成乙醇,反应原理为:2CO2(g)+6H2(g) ![]() C2H5OH(g)+3H2O(g) H<0,设m为起始时的投料比,即m= n(H2)/ n(CO2)。
C2H5OH(g)+3H2O(g) H<0,设m为起始时的投料比,即m= n(H2)/ n(CO2)。
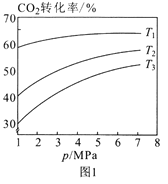
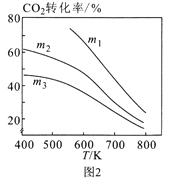
①图1中投料比相同,温度从高到低的顺序为____。
②图2中m1、m2、m3从大到小的顺序为____。
(3)高温电解技术能高效实现下列反应:CO2+H2O ![]() CO+H2+O2,其可将释放的CO2转化为具有工业利用价值的产品。工作原理示意图如下:
CO+H2+O2,其可将释放的CO2转化为具有工业利用价值的产品。工作原理示意图如下:
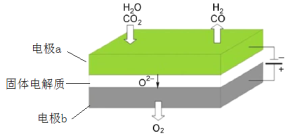
电极a的电极反应式____
(4)工业生产烟气中的CO2捕获技术之一是氨水溶液吸收技术,将烟气冷却至15.5℃~26.5℃后用氨水吸收过量的CO2。已知:NH3·H2O的Kb=1.7×10-5,H2CO3的Ka1=4.3×10-7、Ka2=5.6×10-11。吸收后所得溶液的pH____7(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化锡(SnCl4)常用作有机催化剂、烟雾弹和用来镀锡。某学习小组拟用干燥的氯气和熔融的锡制备 SnCl4 并测定产品的纯度。

已知:i.SnCl4 在空气中极易水解成 SnO2·xH2O;ii.有关物质的物理性质如下表所示。
物质 | 颜色 | 熔点/℃ | 沸点/℃ |
Sn | 银白色 | 232 | 2260 |
SnCl2 | 白色 | 247 | 652 |
SnCl4 | 无色 | -33 | 114 |
回答下列问题:
(1)装置 E 的仪器名称是_____,装置 C 中盛放的试剂是_____。
(2)装置 G 的作用是_____。
(3)实验开始时,正确的操作顺序为_____。
①点燃装置 A 处酒精灯 ②点燃装置 D 处酒精灯 ③打开分液漏斗活塞
(4)得到的产品显黄色是因含有少量_____,可以向其中加入单质___________(填物质名称)而除去。为了进一步分离提纯产品,采取的操作名称是_____。
(5)产品中含少量 SnCl2,测定产品纯度的方法:取 0.400 g 产品溶于足量稀盐酸中,加入淀粉溶液作指示剂,用 0.0100 mo/L 碘酸钾标准溶液滴定至终点,消耗标准液 8.00 mL 。
①滴定原理如下,完成 i 对应的离子方程式。
i._____Sn2++_____IO3-+_____H+= ________Sn4++_____I-+_____
ii.IO3-+5 I2-+6H+ = 3I2 + 3HO
②滴定终点的现象是_____。
③产品的纯度为_____%(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是“国际化学元素周期表年”。1869年门捷列夫把当时已知的元素根据物理、化学性质进行排列,准确预留了甲、乙两种未知元素的位置,并预测了二者的相对原子质量,部分原始记录如下所示。下列说法错误的是

A.甲位于现行元素周期表第四周期第ⅢA族
B.原子半径比较:甲>乙>Si
C.原子序数:甲-Ca=1
D.推测乙的单质可以用作半导体材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com