
| A、分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
| B、蒸馏时,温度计水银球应浸没在液体中 |
| C、蒸馏中,冷却水应从冷凝管的下口通入,上口流出 |
| D、当蒸发到剩有少量液体时,停止加热,利用余热将液体蒸干 |


科目:高中化学 来源: 题型:
| A、由水电离产生的c(H+)=1.0×10-2 mol?L-1 |
| B、pH=12 |
| C、pH=2 |
| D、混合后的溶液溶质的物质的量浓度为0.02 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

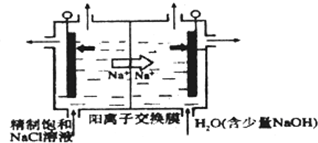
查看答案和解析>>
科目:高中化学 来源: 题型:
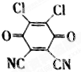 已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E.又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的.D原子得到一个电子后其3p轨道将全充满.B+离子比D原子形成的离子少一个电子层.C与B可形成BC型的离子化合物.E的原子序数为29.
已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E.又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的.D原子得到一个电子后其3p轨道将全充满.B+离子比D原子形成的离子少一个电子层.C与B可形成BC型的离子化合物.E的原子序数为29.| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ?mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化镁、氢氧化钠 |
| B、硫酸钠、氢氧化钡 |
| C、氯化铝、氨水 |
| D、溴化亚铁、氯水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某吸热反应能自发进行,因此该反应是熵增反应 |
| B、NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中 |
| C、增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 |
| D、可燃冰主要甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com