
(8分)工业上采用的一种污水处理方法是:保持污水的pH在5.0-6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。某科研小组用此法处理污水,设计装置示意图,如图所示。
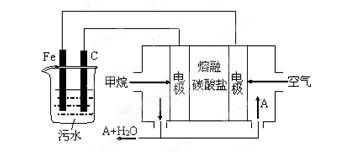
⑴实验时若污水中离子浓度较小,导电能力较差,无法使悬浮物形成浮渣。此时,应向污水中加入适量的__________。
a.BaSO4 b.CH3CH2OH c.Na2SO4 d.NaOH
⑵电解池阳极发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应式分别是:
Ⅰ._____________________________;Ⅱ.______________________________。
⑶电极反应Ⅰ和Ⅱ的生成物反应得到Fe(OH)3沉淀的离子方程式是____________________。
⑷该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见上图)。A物质的化学式是_________________;
(8分)⑴c (1分) ⑵Fe-2e-=Fe2+ 4OH-- 4 e-= 2H2O+O2↑
⑶4Fe2++10H2O + O2= 4Fe(OH)3↓+8H+
⑷CO2 (1分)
【解析】(1)综合考虑,应加入强电解质Na2SO4可满足要求,而BaSO4溶解度太小,电离出的离子太少、CH3CH2OH为非电解质、NaOH为强腐蚀性物质,均排除;
(2)根据燃料电池图示可得出铁是阳极,铝是阴极,阳极反应式为Fe-2e-=Fe2+,而生成一种无色气体为氧气:4OH-- 4 e-= 2H2O+O2↑
(3)两极分别产生Fe2+和O2,生成Fe(OH)3;
(4)正极:O2+2CO2+4e-=2CO32。;负极:CH4—4e-+4CO32—=5CO2+2H2O
根据正极和负极的电极反应式可知该物质是二氧化碳。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
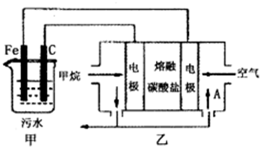 (2013?金华模拟)工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置如图所示.下列说法正确的是( )
(2013?金华模拟)工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置如图所示.下列说法正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
 (2011?德州二模)工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置示意图.如图所示.
(2011?德州二模)工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置示意图.如图所示.
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:



| ||
| △ |
| ||
| △ |
| b×10-7 |
| a-b |
| b×10-7 |
| a-b |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
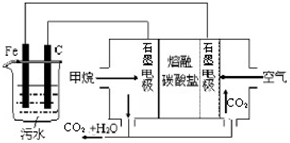 电浮选凝聚法是工业上采用的一种污水处理方法,即保持污水的pH在5.0-6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水作用.其原理如图所示.下列说法正确的是( )
电浮选凝聚法是工业上采用的一种污水处理方法,即保持污水的pH在5.0-6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水作用.其原理如图所示.下列说法正确的是( )查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com