
【题目】下列有关电解质溶液的说法正确的是
A.25℃时 pH=2 的 HF 溶液中,由水电离产生的 OH-浓度为 10-12 mol·L-1
B.0.1 mol·L-1 Na2CO3 溶液中:c(Na+)=c(HCO3 -)+c(H2CO3)+2c(CO32- )
C.向 1 L 1 mol·L-1 的 NaOH 热溶液中通入一定量 Br2,恰好完全反应生成溴化钠、次溴酸钠和溴酸钠(溴 酸为强酸、次溴酸为弱酸)的混合溶液:c(Na+)+c(H+)=6c(BrO3-)+2c(BrO-)+c(HBrO)+c(OH-)
D.25℃时 pH=3 的盐酸与 pH=11 的氨水等体积混合,所得溶液的 pH<7
【答案】AC
【解析】
A. 25℃,pH=2的HF溶液中,c(H+)=10-2mol·L-1,OH-均由水电离,c(OH-)=![]() =
=![]() =10-12mol·L-1,故A正确;
=10-12mol·L-1,故A正确;
B. 0.1 mol·L-1 Na2CO3 溶液中存在电荷守恒:c(H+)+c(Na+)=c(HCO3 -)+c(H2CO3)+2c(CO32-)+ c(OH-),该溶液呈碱性c(OH-)>c(H+),则c(Na+)> c(HCO3 -)+c(H2CO3)+2c(CO32-),故B错误;
C. 溶液中的溶质为NaBr、NaBrO、NaBrO3,它们会电离出阴阳离子,溶剂H2O也会电离出H+、OH-,则溶液中的阳离子有Na+、H+,阴离子有OH-、Br-、BrO-、BrO3-,可列出电荷守恒式:c(Na+)+c(H+)=c(BrO3-)+c(BrO-)+c(Br-)+c(OH-)①,再根据电子得失守恒,可列出:5c(BrO3-)+c(BrO-)+c(HBrO)=c(Br-)②(其中BrO-会水解,部分转化为HBrO),①②式联立,可得:c(Na+)+c(H+)=6c(BrO3-)+2c(BrO-)+c(HBrO)+c(OH-),故C正确;
D. pH=3的盐酸中c(H+)=10-3mol/L,pH=11的氨水中c(OH-)=10-3mol/L,两种溶液H+与OH-离子浓度相等,但由于氨水为弱电解质,不能完全电离,则氨水浓度大于盐酸浓度,反应后氨水过量,溶液呈碱性,则所得溶液的pH>7,故D错误;
故选AC。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】人体尿液中可以分离出具有生长素效应的化学物质——吲哚乙酸,吲哚乙酸的结构简式如图所示。下列有关说法正确的是
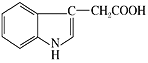
A.分子中含有2种官能团
B.吲哚乙酸苯环上的二氯代物共有四种
C.1 mol吲哚乙酸与足量氢气发生反应,最多消耗5 mol H2
D.分子中不含手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用系统命法写出下列物质名称或结构简式
(1)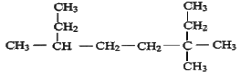 _________。
_________。
(2)顺-2-丁烯的结构简式为:____________。
(3)实验室制取乙炔的化学方程式为:_____________。
(4)乙醇的消去反应:_____________;
(5)3-甲基-1-丁烯:_____________。
(6)2,2,3,3-四甲基戊烷:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素 X。它们有如图所示的转化关系(部分产物及反应条件已略去),下列判断正确的是()

A.X元素不一定为非金属元素B.单质A可能是Cl2,不能是S
C.反应①和②一定为氧化还原反应D.反应①和②都为复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种环保、高效、多功能饮用水处理剂,制备流程如图所示:
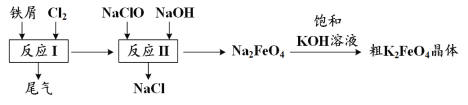
下列叙述错误的是
A.用K2FeO4作水处理剂时,既能杀菌消毒又能净化水
B.反应I中尾气可用FeCl2溶液吸收再利用
C.反应II中氧化剂与还原剂的物质的量之比为3:2
D.该条件下,物质的溶解性:Na2 FeO4< K2FeO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水垢中含有的 CaSO4,可先用 Na2CO3 溶液处理,使之转化为疏松、易溶于酸的 CaCO3。某化学兴趣小组用某浓度的 Na2CO3 溶液处理一定量的 CaSO4 固体,测得所加 Na2CO3 溶液体积与溶液中-lgc(CO32-)的关系如下:
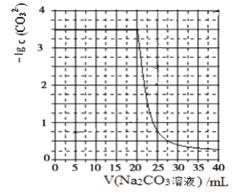
已知Ksp(CaSO4)=9×10-6,Ksp(CaCO3)=3×10-9,lg3=0.5,下列说法不正确的是
A.曲线上各点的溶液满足关系式![]()
B.CaSO4(s)+ ![]() (aq)
(aq)![]() CaCO3(s)+
CaCO3(s)+![]() (aq)K=3×103
(aq)K=3×103
C.该Na2CO3溶液的浓度为1.5 mol/L
D.相同实验条件下,若将Na2CO3溶液的浓度改为原浓度的2倍,则上图曲线整体向上平移1个单位即可
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五氧化二钒广泛用于冶金、化工等行业,用作合金添加剂、生产硫酸或石油精炼用的催化剂等。为回收利用含钒催化剂,研制了一种利用废催化剂(含有V2O5、VOSO4、不溶性硅酸盐)回收V2O5的新工艺流程如下:
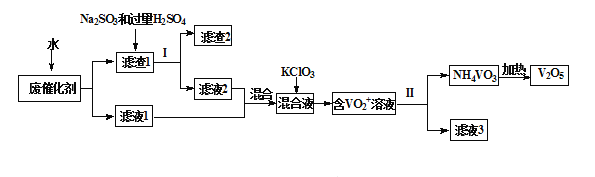
已知:a.部分含钒物质常温下在水中的溶解性如下表所示:
物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
b.![]() +2OH-
+2OH-![]()
![]() +H2O
+H2O
回答下列问题:
(1)用水浸泡废催化剂,为了提高单位时间内废钒的浸出率,可以采取的措施为_________(写一条)。
(2)滤液1和滤液2中钒的存在形式相同,其存在形式为_______________(填离子符号)。
(3)在滤渣1中加入Na2SO3和过量H2SO4溶液发生反应的化学方程式为_____________。
(4)生成VO2+的反应中消耗1molKClO3时转移6mol电子,该反应的离子方程式为________________
(5)结合化学用语,用平衡移动原理解释加入氨水的一种作用为__________________
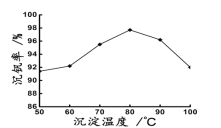
(6)最后钒以NH4VO3的形式沉淀出来。以沉钒率(NH4VO3沉淀中V的质量和废催化剂V的质量之比)表示该步反应钒的回收率。请解释下图温度超过80℃以后,沉钒率下降的可能原因是________________________;___________________(写两条)。
(7)该工艺流程中可以循环利用的物质为__________________。
(8)测定产品中V2O5的纯度:称取a g产品,先用硫酸溶解,得到(VO2)2SO4溶液。再加入b1 mL c1 mol·L1 (NH4)2Fe(SO4)2溶液(VO2++2H++Fe2+==VO2++Fe3++H2O)。最后用c2 mol·L1 KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2 mL。已知被还原为Mn2+,假设杂质不参与反应。则产品中V2O5(摩尔质量:182 g·mol1)的质量分数是______。(列出计算式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学键的键能是指气态原子间形成1 mol化学键时释放的能量。如H(g)+I(g)![]() H—I(g)放出297 kJ的能量,即H—I键的键能为297 kJ·mol-1,也可以理解为破坏1 mol H—I键需要吸收297 kJ的热量。下表是一些键能的数据(单位:kJ·mol-1)。
H—I(g)放出297 kJ的能量,即H—I键的键能为297 kJ·mol-1,也可以理解为破坏1 mol H—I键需要吸收297 kJ的热量。下表是一些键能的数据(单位:kJ·mol-1)。
共价键 | 键能 | 共价键 | 键能 | 共价键 | 键能 | 共价键 | 键能 |
H—H | 436 | Cl—Cl | 243 | H—Cl | 431 | H—O | 467 |
S | 255 | H—S | 339 | C—F | 427 | C—O | 358 |
C—Cl | 330 | C—I | 218 | H—F | 565 | N≡N | 945 |
回答下列问题:
(1)一个化学反应的反应热(设反应物、生成物均为气态)与反应物和生成物中的键能之间有密切的关系。由表中数据计算下列热化学方程式中的热效应:H2(g)+Cl2(g)![]() 2HCl(g) ΔH=____。
2HCl(g) ΔH=____。
(2)共价键的极性强弱对化学反应有很大的影响。卤代烃RX在同样条件下发生碱性水解反应(RX+NaOH![]() R—OH+NaX)时,RF、RCl、RBr、RI(R相同)的反应活性由小到大的顺序是_______。
R—OH+NaX)时,RF、RCl、RBr、RI(R相同)的反应活性由小到大的顺序是_______。
(3)根据表中数据判断CCl4的稳定性____(填“大于”或“小于”)CF4的稳定性。
(4)试预测C—Br键的键能范围(填具体数值):___<C—Br键的键能<____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20mL 0.1mol/LH2R(二元弱酸)溶液中滴加0.1mol/LNaOH溶液,溶液pH与加入NaOH溶液体积的关系如图所示。下列有关说法正确的是

A. a点所示溶液中:c (H2R) + c (HR-)+ c (R2-)=0.lmol/L
B. b点所示溶液中:c (Na+) >c(HR-)> c (H2R)>c(R2-)
C. 对应溶液的导电性:b > c
D. a、b、c、d中,d点所示溶液中水的电离程度最大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com