
a mol·L-1的NaHSO3溶液的pH约为5,下列判断不正确的是
[ ]
A.[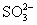 ]+[
]+[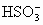 ]+[H2SO3]=a mol·L-1
]+[H2SO3]=a mol·L-1
B.[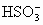 ]+2[
]+2[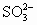 ]<a mol·L-1
]<a mol·L-1
C.[Na+]>[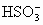 ]>[
]>[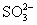 ]>[OH-]
]>[OH-]
D.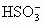 的水解程度小于电离程度
的水解程度小于电离程度
科目:高中化学 来源: 题型:
Ⅰ.(6分)把0.4 mol X气体和0.6mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)===nZ(g)+6W(g);2 min末已生成0.3mol W,若测知以Z的浓度变化表示的反应速率为0.05mol·(L·min)-1。试计算:前2min内用X的浓度变化表示的平均反应速率为 ;2 min末时Y的浓度为 ;化学方程式中n的值是________。
Ⅱ.(8分)将64g铜与200mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为22.4L。请回答:
(1)NO的体积为 L,NO2的体积为 L。
(2)待产生的气体全部释放后,向溶液中加入VmL a mol·L-1的NaOH溶液,恰好使溶液中的Cu2+ 全部转化成沉淀,则原硝酸溶液的浓度为 mol·L-1。(用含a、V的的式子表示)
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要往其中加入25%的双氧水 g。
(已知:2NO2+2NaOH=NaNO2+NaNO3+H2O; NO+NO2+2NaOH=2NaNO2+H2O)
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江西省高安中学高一上学期期末考试化学试卷(带解析) 题型:计算题
在x mL b mol·L-1 AlCl3溶液中,加入等体积a mol·L-1的NaOH溶液。(1)当a≤3b时,生成Al(OH)3沉淀的物质的量是___________mol。
(2)当a、b满足_____________条件时,无沉淀生成。
(3)当a、b分别满足___________条件时,有沉淀生成且溶液中无Al3+存在,生成Al(OH)3沉淀的物质的量是________ mol
查看答案和解析>>
科目:高中化学 来源:2012届安徽合肥八中高三第四次月考化学试卷 题型:填空题
(6分)在50 mL a mol·L-1的硝酸溶液中,加入6.4 g Cu,全部溶解,假设硝酸的还原产物只有NO2和NO,将反应后溶液用蒸馏水稀释至100 mL时测得c(NO3-)=3 mol·L-1。
(1)求稀释后的溶液pH=________.
(2)若a=9,则生成的气体中NO2的物质的量为________mol。
(3)治理氮氧化物污染的方法之一是用NaOH溶液进行吸收,反应原理如下:
NO2+NO+2NaOH===2NaNO2+H2O
2NO2+2NaOH===NaNO2+NaNO3+H2O
若将上述的NO2和NO的混合气体通入1 mol·L-1的NaOH溶液恰好被吸收,NaOH溶液的体积为________mL。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省济宁市高三上学期期中考试化学试卷(解析版) 题型:实验题
(16分)实验室有NH4HCO3和NaHSO3的干燥粉状混合物,某兴趣小组为测定其中NH4HCO3的含量,设计了用在混合物中加酸的实验方法来测定其质量分数。回答以下问题:
⑴ 化学小组主要选用了下列药品和仪器进行实验。(图中每种仪器装置只选用了一次,铁架台等固定仪器未画出)

请按气流由左向右的方向,仪器连接顺序是(填仪器的接口字母a、b...)
a→ → → → → f →g → → 。
⑵ 实验开始,混合物加酸前,A装置需要鼓入空气,作用是 ;加酸后A装置再次鼓入空气的作用是 。
⑶ E装置的作用是 。
⑷ 实验中,若C瓶中溶液褪色,则测定结果可能会偏 (填“高”或“低”)。为了确
保实验中C瓶溶液不褪色,若取样品的质量为m g,实验前 E中所装 a mol·L-1的KMnO4
溶液体积(V)不少于 mL。
⑸ 若混合物样品质量为13.1 g,充分作用后碱石灰增重4.4 g,则混合物中NH4HCO3的质
量分数为 。
⑹ 从定量测定的准确性考虑,该套装置还应作进一步的改进是 。
可能用到的相对原子质量:H~1 C~12 N~14 O~16 Na~23 S~32
查看答案和解析>>
科目:高中化学 来源:2011-2012年江苏省无锡市高一下学期期中考试化学试卷(解析版) 题型:计算题
Ⅰ.(6分)把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)===nZ(g)+6W(g);2 min末已生成0.3 mol W,若测知以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1。试计算:前2 min内用X的浓度变化表示的平均反应速率为 ;2 min末时Y的浓度为 ;化学方程式中n的值是________。
Ⅱ.(8分)将64g铜与200mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为22.4L。请回答:
(1)NO的体积为 L,NO2的体积为 L。
(2)待产生的气体全部释放后,向溶液中加入VmL a mol·L-1的NaOH溶液,恰好使溶液中的Cu2+ 全部转化成沉淀,则原硝酸溶液的浓度为 mol·L-1。(用含a、V的的式子表示)
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要往其中加入25%的双氧水 g。
(已知:2NO2+2NaOH=NaNO2+NaNO3+H2O; NO+NO2+2NaOH=2NaNO2+H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com