
(13分)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙、Ca2+、Mg2+、Fe3+、SO等杂质,不符合电解要求,因此必须经过精制.某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
步骤1:取一定量的粗盐,置于烧杯中,加入足量的水,配成粗盐水;
步骤2:向粗盐水中加入除杂试剂,然后进行过滤,滤去不溶物,再向滤液中加入盐酸
调节盐水的pH;
步骤3:将得到的溶液蒸发浓缩、冷却、结晶、过滤、烘干即得精盐;
请回答以下问题:
(1)上述实验中的过滤操作需要烧杯、____________、____________等玻璃仪器.
(2)步骤2中常用Na2CO3、NaOH、BaCl2作为除杂试剂,则加入除杂试剂的顺序为:
________________.
(3)步骤2中,判断加入BaCl2已过量的方法是:_______________________________
_______________________.
(4)步骤2中,若先用盐酸调节pH再过滤,将会对实验结果产生影响,其原因是
________________________________________________________________________.
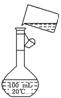 (5)为检验精盐纯度,需配制150 mL 0.2 mol/L NaCl(精盐)溶液,右图是该
(5)为检验精盐纯度,需配制150 mL 0.2 mol/L NaCl(精盐)溶液,右图是该
同学转移溶液的示意图,图中的两处错误是:[来源:学|科|网]
________________________________________________
________________________________________________.
若在定容时仰视,则所配溶液的浓度_____________________________________
0.2 mol/L(填“大于”或“小于”);若定容不慎超过刻度线,应采用的处理方法是: ________________________________________________________________________.
(1)玻璃棒 漏斗;(2)NaOH→BaCl2→Na2CO3(或BaCl2→NaOH→Na2CO3);(3)取所得溶液的上层清液1~2滴于滴定板上,再滴入1~2滴BaCl2溶液,若溶液未变混浊,则表明BaCl2已过量;(4)在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度;(5)未用玻璃棒引流;未采用150 mL容量瓶 小于 重新配制。
【解析】过滤装置由铁架台(含铁圈)、玻璃棒、漏斗、烧杯、滤纸等组成.本着“除杂不掺杂”的原则,应使杂质变为沉淀或气体或本体物质,故使Ca2+、Mg2+、Fe3+、SO等离子变为沉淀,Ca2+常以碳酸钙形式沉淀,Mg2+可以氢氧化镁或碳酸镁形式沉淀,Fe3+常以氢氧化铁形式沉淀,SO常以硫酸钡形式沉淀,故应先加入BaCl2即可.判断加入BaCl2已过量的方法则应先取少量液体,加入BaCl2或碳酸钠即可.步骤2中,若先用盐酸调节pH再过滤,则会使出现的难溶碳酸盐再溶解,故应过滤后再加盐酸.由图可解答问题(5)缺少玻璃棒引流、容量瓶型号不对。


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
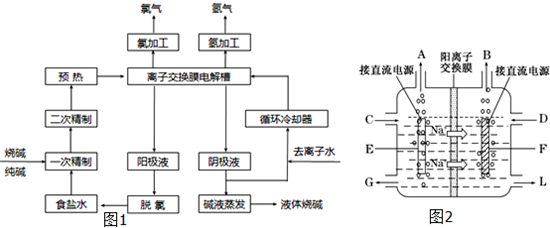
 工业上电解制碱的技术是用离子交换膜法,主要原料是饱和食盐水.下图为离子交换膜法电解原理示意图:请回答下列问题:
工业上电解制碱的技术是用离子交换膜法,主要原料是饱和食盐水.下图为离子交换膜法电解原理示意图:请回答下列问题:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(13分)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙、Ca2+、Mg2+、Fe3+、SO等杂质,不符合电解要求,因此必须经过精制.某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
步骤1:取一定量的粗盐,置于烧杯中,加入足量的水,配成粗盐水;
步骤2:向粗盐水中加入除杂试剂,然后进行过滤,滤去不溶物,再向滤液中加入盐酸
调节盐水的pH;
步骤3:将得到的溶液蒸发浓缩、冷却、结晶、过滤、烘干即得精盐;
请回答以下问题:
(1)上述实验中的过滤操作需要烧杯、____________、____________等玻璃仪器.
(2)步骤2中常用Na2CO3、NaOH、BaCl2作为除杂试剂,则加入除杂试剂的顺序为:
________________.
(3)步骤2中,判断加入BaCl2已过量的方法是:_______________________________
_______________________.
(4)步骤2中,若先用盐酸调节pH再过滤,将会对实验结果产生影响,其原因是
________________________________________________________________________.
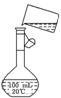 (5)为检验精盐纯度,需配制150 mL 0.2 mol/L NaCl(精盐)溶液,右图是该
(5)为检验精盐纯度,需配制150 mL 0.2 mol/L NaCl(精盐)溶液,右图是该
同学转移溶液的示意图,图中的两处错误是:
________________________________________________
________________________________________________.
若在定容时仰视,则所配溶液的浓度_____________________________________
0.2 mol/L(填“大于”或“小于”);若定容不慎超过刻度线,应采用的处理方法是:________________________________________________________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com