
【题目】海洋是一个远未完全开发的巨大化学资源宝库。
(1)无需经过化学变化就能从海水中获得的物质是________(填序号)
A 氯气 B 淡水 C烧碱 D 食盐
(2)从海水制得的粗盐中含有较多的Mg2+、Ca2+、SO![]() 等,要除去这些离子,下列加入药品顺序正确的是________(填序号)
等,要除去这些离子,下列加入药品顺序正确的是________(填序号)
A NaOH溶液→Na2CO3溶液→BaCl2溶液B BaCl2溶液→NaOH溶液→Na2CO3溶液
C NaOH溶液→BaCl2溶液→Na2CO3溶液D Na2CO3溶液 →NaOH溶液→ BaCl2溶液
(3)从海水中得到溴的过程如下:
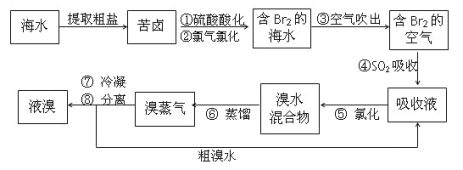
①写出由“苦卤”变成“含溴海水”的离子方程式________
②写出④发生反应的化学方程式________
③某化学小组的同学为了了解从工业溴中提纯溴的方法,查阅了有关资料:Br2的沸点为59 ℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如图所示实验装置:

图中仪器B冷却水的出口为______(填“甲”或“乙”),D装置的作用是__________,反应的离子方程式为__________,整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是__________。
(4)已知某溶液中Cl-、Br-、I-的物质的量之比为2:3:4,现欲使溶液中的Cl-、Br-、I-的物质的量之比为变为4:3:2,那么通入Cl2的物质的量是原溶液中I-的物质的量的__________
【答案】BD BC Cl2+2Br-=Br2+2Cl- Br2+SO2+2H2O=2HBr+H2SO4 甲 吸收尾气 Br2 +2OH-=Br-+BrO-+H2O Br2能腐蚀橡胶 1/4
【解析】
(1)海水经过蒸发可得食盐,经过蒸馏可得淡水,都是物理变化。海水中氯以Cl-存在,要获得单质必须失电子才能实现,烧碱要电解饱和食盐水才可得到,发生了化学变化,所以本题答案为:BD;
(2)要除去Mg2+、Ca2+、SO![]() ,则用氢氧化钠溶液除去镁离子、用氯化钡溶液除去硫酸根离子,用碳酸钠溶液除去钙离子和剩余的钡离子,要先除硫酸根,然后再除钙离子,如果加反了,过量的钡离子就无法除去,至于除镁离子,可不受限制,因为过量的氢氧化钠加盐酸可除去,所以A、D中剩余的氯化钡无法除去,故本题答案为:BC;
,则用氢氧化钠溶液除去镁离子、用氯化钡溶液除去硫酸根离子,用碳酸钠溶液除去钙离子和剩余的钡离子,要先除硫酸根,然后再除钙离子,如果加反了,过量的钡离子就无法除去,至于除镁离子,可不受限制,因为过量的氢氧化钠加盐酸可除去,所以A、D中剩余的氯化钡无法除去,故本题答案为:BC;
(3)①“苦卤”中含有溴离子,变成“含溴海水”是用氯气氧化溴离子得到溴单质,离子方程式Cl2+2Br-=Br2+2Cl-,故本题答案为:Cl2+2Br-=Br2+2Cl-;
②步骤④是溴单质和二氧化硫发生了氧化还原反应,发生反应的化学方程式Br2+SO2+2H2O=2HBr+H2SO4,故本题答案为:Br2+SO2+2H2O=2HBr+H2SO4;
③冷凝管中冷却水的流向是下口进,上口出,应是乙口进,甲口出,进入D装置的物质为溴蒸汽,有毒,用碱液吸收挥发的溴单质,可防止污染环境,发生反应的离子方程式为:Br2+2OH-=Br-+BrO-+H2O,溴单质具有氧化性,可腐蚀橡胶,故整套装置中不能用橡胶塞和橡胶管,所以本题正确答案为:甲;吸收尾气;Br2+2OH-=Br-+BrO-+H2O;Br2能腐蚀橡胶;
(4)已知还原性I->Br->Cl-,反应后I-有剩余,说明Br-浓度没有变化,通入的Cl2只与I-发生反应,
设原溶液中含有2mol Cl-,3 mol Br-,4mol I-,通入Cl2后它们的物质的量之比变为4:3:2,则各离子物质的量分别为:4mol Cl-、3mol Br-、2mol I-,Cl-增加了2mol,则需1 mol Cl2,则通入的Cl2物质的量是原溶液中I-物质的量的1/4,故本题答案为:1/4。


科目:高中化学 来源: 题型:
【题目】按要求填空
(1)写出下列仪器的名称

② _____________③____________④________________
(2)分离出碘水中的碘应先选择装置____________(填I、II、III) 进行操作;
该分离提纯的方法叫_____________ ;
进行该操作,需加一试剂,在选择试剂时,下列性质你认为哪些性质是必需的:____________(填序号)
①与碘水不反应 ②I2在其中溶解程度大于在水中的溶解度 ③与水不相容 ④密度要比水小
如果选择苯C6H6(是一种密度比水小的有机溶剂)作这种试剂,现象是________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吡喹酮(H)是一种治疗血吸虫病的药物,合成路线如下图所示:

已知:I R-Cl+NaCN![]() R-CN+NaCl
R-CN+NaCl
ii 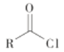 +R′-NH-R"+NaOH
+R′-NH-R"+NaOH![]()
 +NaCl+H2O(R、R′表示烃基,R"表示烃基或H)
+NaCl+H2O(R、R′表示烃基,R"表示烃基或H)
(1)A 属于芳香烃,其名称是________________________。
(2)步骤②的反应类型是_______________________________。
(3)B 的一种同分异构体,含苯环且核磁共振氢谱中出现三组峰,其结构简式为______________。
(4)③中 1mol C 理论上需要消耗__________________mol H2生成 D。
(5)④的化学方程式是 ________。
(6)F 中含氧官能团是 ![]() 和_______________________(填名称)。
和_______________________(填名称)。
(7)试剂 a 的结构简式是___________________。
(8)G→H 分为三步反应,J 中含有 3 个六元环,写出 I、J 的结构简式。
![]()
I:_____;J:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为元素在生物体内的含量分布情况,下列表述错误的是

A. P、S、K、Ca、Zn属于大量元素
B. 在非生物界中都能找到,体现生物界与非生物界的统一性
C. Ⅱ和Ⅲ为生物体的必需元素,一旦缺乏就可能会导致相应的病症
D. Ⅲ含量虽少,却是生物体正常生命活动不可缺少的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1 L 0.1 mol·L-1 NH4Cl溶液中,不断加入固体NaOH后,NH![]() 与NH3 · H2O的变化趋势如下图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )
与NH3 · H2O的变化趋势如下图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )

A. 在M点时,n(OH-)-n(H+)=(a-0.05) mol
B. 随着NaOH的加入,![]() 不断增大
不断增大
C. M点溶液中水的电离程度比原溶液小
D. 当n(NaOH)=0.1 mol时,c(OH-)>c(Cl-)-c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是原子序数依次递增的五种常见元素。A、B元素组成的气态化合物M的水溶液呈碱性,C元素是地壳中含量最多的元素,D的单质在C的单质中燃烧后的产物可以使品红溶液褪色,E是金属元素。
(1)写出A、C两种元素组成的化合物A2C2的电子式_______。
(2)若将E金属投入盐酸中,生成了浅绿色溶液N。则N的酸性溶液与A2C2反应的离子方程式为______________________________________。
(3)R是B的氧化物,通常情况下呈红棕色。现有一试管R,欲使元素B全部转化为它的最高价氧化物对应的水化物,故进行如下实验操作:将盛有R的试管倒扣在水槽中,______。
(4)有人设想寻求合适的催化剂和电极材料,以A2、B2为电极反应物,以HCl—NH4Cl溶液为电解质溶液制造新型燃料电池,试写出该电池的正极反应式_____________,放电时,溶液中的H+移向_________(填正极或负极)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.为了探究一种固体化合物甲(仅含3种元素)的组成和性质,设计并完成如下实验:(气体体积已经换算成标准状况下的体积)
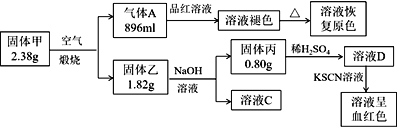
请回答:
(1)写出化合物甲的化学式________。
(2)写出形成溶液C的化学方程式:_____________。
(3)写出气体A通入溶液D中,发生反应的离子反应方程式__________。
Ⅱ.近年来化学家又研究开发出了用 H2和CH3COOH 为原料合成乙醇(反应Ⅰ),同时会发生副反应Ⅱ。
反应Ⅰ.CH3COOH(g)+2H2(g)![]() CH3CH2OH(g) +H2O(g) △H1
CH3CH2OH(g) +H2O(g) △H1
反应Ⅱ. CH3COOH(g)+H2(g)![]() CO(g)+CH4(g)+H2O(g) △H2>0
CO(g)+CH4(g)+H2O(g) △H2>0
已知:乙醇选择性是转化的乙酸中生成乙醇的百分比。请回答:
(1)反应Ⅰ一定条件下能自发进行,则△H1 ___0。(填“>”或“<”)
(2)某实验中控制 CH3COOH 和 H2 初始投料比为 1∶1.5,在相同压强下,经过相同反应时间测得如下实验数据:
温度(K) | 催化剂 | 乙酸的转化率(%) | 乙醇选择性(%) |
573 | 甲 | 40 | 50 |
573 | 乙 | 30 | 60 |
673 | 甲 | 55 | 35 |
673 | 乙 | 40 | 50 |
①有利于提高CH3COOH转化为CH3 CH2OH平衡转化率的措施有______。
A 使用催化剂甲 B 使用催化剂乙
C 降低反应温度 D 投料比不变,增加反应物的浓度
E 增大CH3COOH和H2的初始投料比
②673K甲催化剂作用下反应Ⅰ已达平衡状态,测得乙酸的转化率为50%,乙醇的选择性40%,若此时容器体积为 1.0L,CH3COOH 初始加入量为2.0mol,则反应Ⅰ的平衡常数 K= _____。
③表中实验数据表明,在相同温度下不同的催化剂对CH3COOH转化成CH3CH2OH的选择性有显著的影响,其原因是_________________。
(3)在图中分别画出I在催化剂甲和催化剂乙两种情况下“反应过程-能量”示意图。_____

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A 0.2mol在氧气中充分燃烧后,生成化合物B、C各1.2mol。
(1)烃A的分子式为___________。
(2)若取一定量的烃A完全燃烧后,生成B、C各3mol,则有_______g烃A参加了反应,燃烧时消耗标准状况下的氧气________L。
(3)若烃A不能使溴水褪色,但在一定条件下,能与氯气发生取代反应,其一氯代物只有一种,则烃A的结构简式为_______________;请用适当文字说明你的推断理由:__________________________________。
(4)若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定,分子中含有4个甲基,烃A可能的结构简式为____________________________________(写一个);比烃A少2个碳原子的同系物有___________种同分异构体,其中能和H2发生加成反应生成2-甲基丙烷的烯烃的名称是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现将0.1mol某烃完全燃烧生成的气体全部依次通过浓硫酸和氢氧化钠溶液,经测定,前者增重10.8g,后者增重22g(假定气体全部吸收)。试通过计算推断该烃的分子式___(要有简单计算过程)并写出所有同分异构体___。若该烃的一氯代物只有一种,试写出该氯代烃的结构简式___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com