
【题目】按要求填空
(1)写出下列仪器的名称
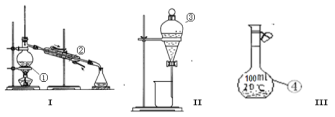
② _____________③____________④________________
(2)分离出碘水中的碘应先选择装置____________(填I、II、III) 进行操作;
该分离提纯的方法叫_____________ ;
进行该操作,需加一试剂,在选择试剂时,下列性质你认为哪些性质是必需的:____________(填序号)
①与碘水不反应 ②I2在其中溶解程度大于在水中的溶解度 ③与水不相容 ④密度要比水小
如果选择苯C6H6(是一种密度比水小的有机溶剂)作这种试剂,现象是________________
科目:高中化学 来源: 题型:
【题目】下列各组微粒的空间构型相同的共有几个( )
①NH3和H2O ②BF3和H3O+ ③NH3和H3O+ ④O3和SO2 ⑤CO2和BeCl2 ⑥![]() 和
和![]() ⑦NF3和Al2Cl6
⑦NF3和Al2Cl6
A.6B.5C.4D.3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】王浆酸是从蜂王浆中分离出的一种有机酸,它有很好的杀菌、抗癌、抗放射及强化机体、增强免疫力的作用,其结构如下所示。有关王浆酸的说法不正确的是( )
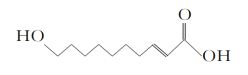
A. 分子式为C10H18O3
B. 能使溴的四氯化碳溶液褪色
C. 一定条件下能发生取代反应和氧化反应
D. 1 mol王浆酸最多能中和2 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种高效净水剂。已知:K2FeO4易溶于水,其溶液呈紫色、微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。某小组同学用下图装置制备并探究K2FeO4的性质。制备原理:3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O,装置如图所示(夹持装置略)。
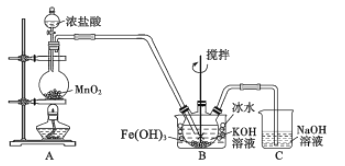
(1)盛放二氧化锰的仪器名称___________________,装置C的作用是____________________。
(2)装置A 中反应的化学方程式是________________________________________。
(3)实验时采用冰水浴的原因是________________,此装置存在一处明显缺陷,请指出___________。
(4)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,一般用75%乙醇进行洗涤,其目的是_________。
(5)查阅资料知,K2FeO4能将 Mn2+氧化成 MnO4-。该小组设计如下实验进行验证:
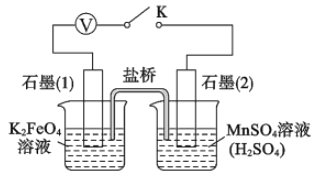
关闭K,左烧杯溶液变黄色,右烧杯溶液变紫色。检验左侧烧杯溶液呈黄色的原因,需要的试剂是_______;写出上图中负极的电极反应式: _________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某浓度的氨水中存在下列平衡:NH3·H2O![]() NH4++OH-,若想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是( )
NH4++OH-,若想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是( )
A. 适当升高温度B. 加入NaCl固体C. 加入少量盐酸D. 通入NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗的值, 已知HCl气体的质量为3.65g
(1)HCl的物质的量为_______________
(2)HCl的分子个数为_______________
(3)原子总数为 _______________
(4)在标准状况的体积为________________
(5)所含电子数为 _________________
(6)如把 HCl完全溶于水配置成1L 溶液,该溶液中H+的物质的量浓度为_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如右图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )

A. 上下移动①中铜丝可控制SO2的量
B. ②中选用品红溶液验证SO2的生成
C. ③中选用NaOH溶液吸收多余的SO2
D. 为确认CuSO4生成,向①中加水,观察颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇结构式如图所示,“箭头”表示乙醇发生化学反应时分子中可能断键的位置,下列叙述中不正确的是( )
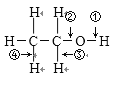
A. 与钠反应时断裂①键B. 发生消去反应时断裂②④键
C. 与乙酸发生酯化反应时断裂②键D. 发生催化氧化反应时断裂①③键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是一个远未完全开发的巨大化学资源宝库。
(1)无需经过化学变化就能从海水中获得的物质是________(填序号)
A 氯气 B 淡水 C烧碱 D 食盐
(2)从海水制得的粗盐中含有较多的Mg2+、Ca2+、SO![]() 等,要除去这些离子,下列加入药品顺序正确的是________(填序号)
等,要除去这些离子,下列加入药品顺序正确的是________(填序号)
A NaOH溶液→Na2CO3溶液→BaCl2溶液B BaCl2溶液→NaOH溶液→Na2CO3溶液
C NaOH溶液→BaCl2溶液→Na2CO3溶液D Na2CO3溶液 →NaOH溶液→ BaCl2溶液
(3)从海水中得到溴的过程如下:
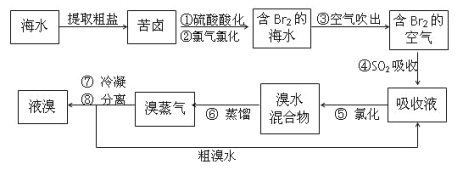
①写出由“苦卤”变成“含溴海水”的离子方程式________
②写出④发生反应的化学方程式________
③某化学小组的同学为了了解从工业溴中提纯溴的方法,查阅了有关资料:Br2的沸点为59 ℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如图所示实验装置:
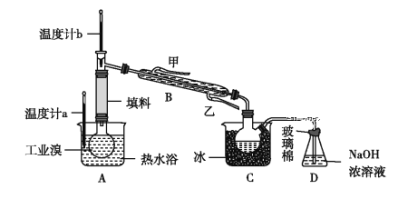
图中仪器B冷却水的出口为______(填“甲”或“乙”),D装置的作用是__________,反应的离子方程式为__________,整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是__________。
(4)已知某溶液中Cl-、Br-、I-的物质的量之比为2:3:4,现欲使溶液中的Cl-、Br-、I-的物质的量之比为变为4:3:2,那么通入Cl2的物质的量是原溶液中I-的物质的量的__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com