
| A. | 甲苯与氯气在光照下反应主要生成2,4-二氯甲苯 | |
| B. | 苯和浓硝酸、浓硫酸共热并保持50-60℃反应生成硝基苯 | |
| C. | 甲苯在合适条件下催化加氢可生成甲基环己烷 | |
| D. | 乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷 |
分析 A.甲苯和氯气在光照条件下发生取代反应,取代甲基上氢原子,且生成多种取代物;
B.在50-60℃、浓硫酸作催化剂条件下,苯和浓硝酸发生取代反应或硝化反应生成硝基苯;
C.在一定条件下,甲苯能和氢气发生加成反应;
D.乙烯和溴能发生加成反应生成溴代烷.
解答 解:A.甲苯和氯气在光照条件下发生取代反应,取代甲基上氢原子,且生成多种取代物,有一氯甲苯、二氯甲苯、三氯甲苯、四氯甲苯,故A错误;
B.在50-60℃、浓硫酸作催化剂条件下,苯和浓硝酸发生取代反应或硝化反应生成硝基苯,该反应需要水浴加热,故B正确;
C.在一定条件下,甲苯中苯环能和氢气发生加成反应生成甲基环己烷,故C正确;
D.乙烯中含有碳碳双键,性质较活泼,能和溴能发生加成反应生成1,2-二溴乙烷,故D正确;
故选A.
点评 本题考查有机物结构和性质,涉及苯的同系物、烯烃及苯的反应,明确反应条件对产物影响及物质中官能团及其性质关系是解本题关键,注意A中如果是溴化铁作催化剂,则苯环上氢离子被取代,如果是光照条件下,则甲基上氢离子被取代,为易错点.


 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③④ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 过氧化钠是一种淡黄色固体,在潜水艇中用作制氧剂,供人类呼吸之用.某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.95g过氧化钠样品为原料,制取O2,设计出实验装置(如图):
过氧化钠是一种淡黄色固体,在潜水艇中用作制氧剂,供人类呼吸之用.某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.95g过氧化钠样品为原料,制取O2,设计出实验装置(如图):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某中性溶液中:Na+、Fe3+、SO42-、NO3- | |
| B. | 某无色溶液中:K+、Mg2+、ClO-、SO42- Fe2+ | |
| C. | 能使KSCN变红的溶液中:NH4+、Na+、SiO32-、HCO3- | |
| D. | 水电离产生的c(OH-)=1×10-10mol/L的溶液中:Al3+、SO42-、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
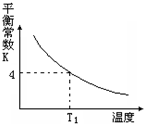 T℃时,将1molX和2molY投入2L的密闭容器中,发生反应:X(g)+Y(g)?2Z(g),X、Y的量随时间变化如下表,该反应的平衡常数随温度的变化如下图,则下列判断正确的是( )
T℃时,将1molX和2molY投入2L的密闭容器中,发生反应:X(g)+Y(g)?2Z(g),X、Y的量随时间变化如下表,该反应的平衡常数随温度的变化如下图,则下列判断正确的是( )| 0 | 1 | 2 | 3 | 4 | 5 | 6 | |
| X | 1 | 0.80 | 0.66 | 0.58 | 0.52 | 0.50 | 0.50 |
| Y | 2 | 1.80 | 1.66 | … | … | … | … |
| A. | 前5min用Z表示的平均反应速率为0.2mol/(L•min) | |
| B. | 该反应的正反应是放热反应,且T1>T | |
| C. | 在T℃时,以1molX、2molY和1molZ充入上述容器中,达到平衡时,X的体积分数不变 | |
| D. | 若温度为T1时,以同样的起始量反应,达到平衡时X的转化率为66.7% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
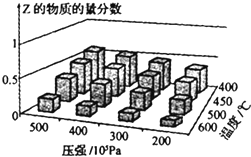
| A. | 在恒温恒压条件下,向已达到平衡的体系中加入少量Z,达新平衡时,Z的物质的量分数增大 | |
| B. | 升高温度,正、逆反应速率都增大,平衡常数增大 | |
| C. | △H>0 m+n>c | |
| D. | 温度不变,减小压强,平衡逆向移动,达新平衡时,A的浓度比原平衡减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 试剂 | 操作方法 |
| A | 除去CH4中的C2H4 | 溴水 | 洗气 |
| B | 除去工业酒精中的水 | CaO | 蒸馏 |
| C | 除去苯中的溴 | 乙醇 | 分液 |
| D | 从肥皂、甘油的混合液中分离出肥皂 | NaCl | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com