
 过氧化钠是一种淡黄色固体,在潜水艇中用作制氧剂,供人类呼吸之用.某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.95g过氧化钠样品为原料,制取O2,设计出实验装置(如图):
过氧化钠是一种淡黄色固体,在潜水艇中用作制氧剂,供人类呼吸之用.某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.95g过氧化钠样品为原料,制取O2,设计出实验装置(如图):分析 (1)Na2O2和H2O生成NaOH和O2,其中Na2O2、H2O、O2写化学式;
(2)制取CO2要选用大理石和盐酸,CaCO3和盐酸反应生成CaCl2、CO2、H2O;
(3)制得的CO2中含有挥发出来的HCl,HCl与NaHCO3反应,可以除去HCl;
(4)二氧化碳和澄清石灰水反应生成碳酸钙白色沉淀;
(5)根据过氧化钠的质量可以生成氧气的体积,理论生成气体的体积-实际氧气的体积=差值.
解答 解:(1)Na2O2和H2O生成NaOH和O2,离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑,
故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑;
(2)制取CO2要选用大理石和盐酸,CaCO3和盐酸反应生成CaCl2、CO2、H2O,离子方程式为CaCO3+H+=Ca2++H2O+CO2↑,
故答案为:CaCO3+H+=Ca2++H2O+CO2↑;
(3)制得的CO2中含有挥发出来的HCl,HCl与NaHCO3反应,可以除去HCl,化学反应方程式为NaHCO3+HCl=NaCl+H2O+CO2↑,
故答案为:NaHCO3+HCl=NaCl+H2O+CO2↑;
(4)D中未反应的二氧化碳进入到E中,二氧化碳与氢氧化钙反应生成碳酸钙,
故答案为:未反应的二氧化碳与石灰水反应所致;
(5)1.95g过氧化钠完全反应生成氧气的体积为v.
2Na2O2----O2;
2mol 22.4L
$\frac{1.95g}{78g/mol}$ v
v=0.28L=280mL>250mL,所以实际收集到的氧气体积比理论计算值小.
280mL-250mL=30mL;
原因是Na2O2可能含有其它杂质;D装置可能有氧气未被排出.
故答案为:小;30;Na2O2可能含有其它杂质或D装置可能有氧气未被排出.
点评 本题考查了钠及其化合物的性质,难度不大,注意掌握离子方程式的书写规则和实验装置图的组合原理.


科目:高中化学 来源: 题型:选择题
| A. | 煤燃烧是化学能转化为光能的过程 | |
| B. | 1 mol 甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 | |
| C. | HCl 和 NaOH 反应的中和热△H=-57.3 kJ•mol-1,则 H2SO4 和 Ca(OH)2 反应中和热△H=2×(-57.3)kJ•mol-1 | |
| D. | 反应 H2(g)+F2(g)═2HF(g);△H=-270 kJ•mol-1说明在相同条件下,1 mol 氢气与 1 mol 氟气的能量总和大于2 mol 氟化氢气体的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某物质灼烧时,焰色反应为黄色,则该物质一定是金属钠 | |
| B. | 与水反应生成酸的物质就是酸性氧化物 | |
| C. | 胶体:分散质颗粒直径在1nm~100nm之间的分散系,能产生丁达尔效应 | |
| D. | 物质的量:衡量物质微粒个数的单位 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图为2012年第29届伦敦奥运会使用的火炬,火炬中的燃料是丙烷(燃烧热为2221.5kJ/mol).下列正确的是( )
如图为2012年第29届伦敦奥运会使用的火炬,火炬中的燃料是丙烷(燃烧热为2221.5kJ/mol).下列正确的是( )| A. | 丙烷燃烧的过程中,化学能全部转化为热能 | |
| B. | 丙烷燃烧的热化学方程式为:C3H8(g)+5O2(g)→3CO2(g)+4H20(g);△H=-2221.5 kJ•mol-1 | |
| C. | 丙烷燃烧的热化学方程式为:C3H8(g)+5O2(g)→3CO2(g)+4H20(l);△H=-2221.5 kJ•mol-1 | |
| D. | 1mol丙烷若先分解生成C、H2,然后C、H2再完全燃烧放出的特例小于2221.5kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 该反应为放热反应 | |
| B. | 该反应一定有能量转化成了化学能 | |
| C. | 反应物比生成物稳定 | |
| D. | 因为反应物的总能量低于生成物的总能量,所以该反应需要加热才能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
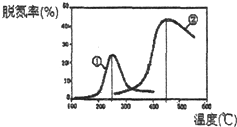 进入冬季北方开始供暖后,雾霾天气愈发严重,各地PM2.5、PM10经常“爆表”.引发雾霾天气的污染物中,最为常见的是机动车尾气中的氮氧化物和燃煤产生的烟气.
进入冬季北方开始供暖后,雾霾天气愈发严重,各地PM2.5、PM10经常“爆表”.引发雾霾天气的污染物中,最为常见的是机动车尾气中的氮氧化物和燃煤产生的烟气.时间/min 温度/℃ | 0 | 10 | 20 | 40 | 50 |
| T1 | 1.2 | 0.9 | 0.7 | 0.4 | 0.4 |
| T2 | 1.2 | 0.8 | 0.56 | … | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯与氯气在光照下反应主要生成2,4-二氯甲苯 | |
| B. | 苯和浓硝酸、浓硫酸共热并保持50-60℃反应生成硝基苯 | |
| C. | 甲苯在合适条件下催化加氢可生成甲基环己烷 | |
| D. | 乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去CO2中混有的HCl:用饱和碳酸钠溶液洗气 | |
| B. | 除去Cu粉中混有的CuO:加适量稀硝酸后,过滤 | |
| C. | 除去Al2O3中混有的SiO2:加NaOH溶液,过滤 | |
| D. | 除去Fe2O3中混有少量的Fe(OH)3:加热灼烧 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com