
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g)  2NH3(g),ΔH<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是( )
2NH3(g),ΔH<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是( )
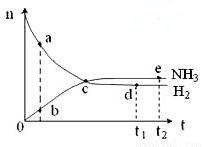
A. 点a的n(H2)和点b的n(NH3)比值为3∶2
B. 点 c处反应达到平衡
C. 点d (t1时刻) 和点 e (t2时刻) 处n(N2)不一样
D. 其他条件不变,773K下反应至t1时刻,n(H2)比右图中d点的值大
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016-2017学年甘肃省嘉峪关市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列说法中有明显错误的是( )
A. 对有气体参加的化学反应,增大压强体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大
B. 升高温度,一般可使活化分子的百分数增大,因而反应速率增大
C. 有效碰撞一定在活化分子之间,活化分子之间发生的碰撞一定为有效碰撞
D. 加入适宜的催化剂,可使活化分子的百分数大大增加,从而成千上万倍地增大化学反应的速率
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省新余市高二下学期入学考试化学试卷(解析版) 题型:实验题
绿矾(FeSO4 • 7H2O)是治疗缺铁性贫血的特效药.下面是以商品级纯度铁屑(含少量锡等杂质)生产绿矾的一种方法:
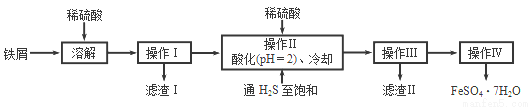
已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH 为3.0,沉淀完全时的pH为5.5:
回答下列问题:
(1)操作Ⅱ中用硫酸酸化至pH=2且通入硫化氢至饱和的目的是:
①除去操作I所得溶液中含有的Sn2+等杂质离子;
②____________________________;
③____________________________。
(2)操作IV的顺序依次为:_______________、_______________、过滤、洗涤。
(3)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;②___________________。
(4)测定绿矾产品中Fe2+ 含量的方法是:a.称取8.680g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.02000 mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为30.00 mL(滴定时发生反应的离子方程式为:5Fe2+ + MnO4- + 8H+ ═ 5Fe3+ + Mn2+ + 4H2O)
①计算上述样品中FeSO4 • 7H2O的质量分数为_________________(结果保留4位有效数字,FeSO4 • 7H2O的摩尔质量为 278g/mol)
②若用上述方法测定的样品中FeSO4•7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有:样品中存在少量的杂质、___________________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省新余市高二下学期入学考试化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 能使石蕊呈蓝色的溶液中:Na+ K+ NO3- CO32-
B. 水电离的c (H)=10-12 mol·L-1 的溶液中:HCO3- SiO32- Cu2+ NH4+
C. c (H+ )/ c(OH -)=1012 的溶液中:S2O32- CrO42- ClO- Mg2+
D. 无色溶液中:Fe3+ SCN- Cr2O72- Cl-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省大同市高二2月月考化学试卷(解析版) 题型:简答题
请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)在一定体积的密闭容器中,进行如下化学反应,CO2(g)+H2(g) CO(g)+H2O(g),平衡常数K与温度t℃的关系如下表:
CO(g)+H2O(g),平衡常数K与温度t℃的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
①该反应的化学平衡常数表达式为________________________。
②该反应为反应___________(填“吸热”或“放热”)。
③某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度
为___________℃。
(2)工业上一般以CO和H2为原料合成甲醇,一定温度下在恒容容器中,该反应的热化学方程式为:CO(g)+2H2(g) CH3OH(g)△H1=-116kJ·mol-1
CH3OH(g)△H1=-116kJ·mol-1
①下列措施中能说明反应达到平衡状态的是___________。
A.体系压强保持不变
B.混合气体的密度保持不变
C.CO与H2的浓度之比为1∶2
D.单位时间内,消耗2molH2的同时消耗1molCH3OH
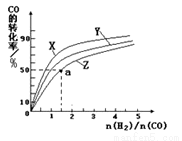
②在恒容容器中合成甲醇,当温度分别为230℃、250℃和270℃时,CO的转化率与n(H2)/n(CO)的起始组成比的关系如图所示。已知容器体积1L,起始时CO的物质的量均为1mol。据此判断在上述三种温度中,曲线Z对应的温度是___________;利用图中a点对应的数据,计算该反应在对应温度下的平衡常数K等于___________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省大同市高二2月月考化学试卷(解析版) 题型:选择题
一定温度下在容积恒定的密闭容器中,进行反应A(s)+2B(g)  C(g)+D(g),当下列物理量不发生变化时,能作为该反应已达到化学平衡状态的标志是( )
C(g)+D(g),当下列物理量不发生变化时,能作为该反应已达到化学平衡状态的标志是( )
①混合气体的密度②容器内气体的压强③混合气体的总物质的量④B物质的量浓度
A. ①④ B. ②③ C. ②③④ D. 只有④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省大同市高二2月月考化学试卷(解析版) 题型:选择题
为了测定中和反应的反应热,计算时至少需要的数据是( )
①酸的浓度和体积 ②碱的浓度和体积 ③比热容④反应后溶液的质量
⑤生成水的物质的量 ⑥反应前后溶液温度变化 ⑦操作所需的时间
A. ①②③⑥ B. ①③④⑥ C. ③④⑤⑥ D. 全部
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省葫芦岛市高一下学期选拔考试化学试卷(解析版) 题型:选择题
某温度下,将Cl2通入氢氧化钾溶液中,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO﹣与ClO3-离子的物质的量之比是1:2,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为( )
A. 2:3 B. 4:3 C. 10:3 D. 11:3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二下学期开学考试化学试卷(解析版) 题型:简答题
A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且有两种常见化合物DA2和DA3;工业上电解熔融C2A3制取单质C;B、E除最外层均只有2个电子外,其余各层全充满,E位于元素周期表的ds区。回答下列问题:
(1)B、C中第一电离能较大的是_________,基态D原子价电子的轨道表达式为____________。
(2)DA2分子的VSEPR模型是____________。H2A比H2D熔沸点高得多的原因是____________。
(3)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图所示。已知C2Cl6 在加热时易升华,与过量的NaOH溶液反应可生成Na[C(OH)4]。

① C2Cl6属于____________晶体(填晶体类型),其中C原子的杂化轨道类型为____________杂化。
② [C(OH)4]-中存在的化学键有___________。
(4)工业上制备B的单质是电解熔融B的氯化物,而不是电解BA,原因是_____________。
(5)B、C的氟化物晶格能分别是2957 kJ·mol-1、5492 kJ·mol-1,二者相差很大的原因是____________。
(6)D与E所形成化合物晶体的晶胞如图所示。

① 在该晶胞中,E的配位数为______________。
② 已知该晶胞的密度为ρ g/cm3,则其中两个D原子之间的距离为_________ pm(列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com