
【题目】已知A为常见的金属单质,根据如下所示的转化关系回答下列问题:
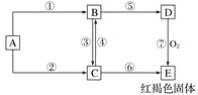
(1)写出下列物质的化学式:
A________,B_______,C_______,D_________,E__________。
(2)反应③的离子方程式为_______________;
反应④的离子方程式为___________;
反应⑦的化学方程式为_____________。
【答案】Fe FeCl2 FeCl3 Fe(OH)2 Fe(OH)3 2Fe2++Cl2=2Fe3++2Cl- 2Fe3++Fe=3Fe2+ 4Fe(OH)2+O2+2H2O=4Fe(OH)3
【解析】
A为常见的金属单质,其某种化合物是红褐色固体,该红褐色固体E为Fe(OH)3,由转化关系图可知,A是Fe单质,Fe与HCl反应产生的B是FeCl2,Fe与Cl2反应产生的C是FeCl3,FeCl2与Cl2反应产生FeCl3,FeCl3与Fe反应产生FeCl2,FeCl2与碱NaOH反应产生的D为Fe(OH)2,Fe(OH)2在溶液中被空气中的O2氧化为Fe(OH)3,FeCl3与NaOH反应也产生Fe(OH)3,然后结合物质的性质及化学用语来解答。
(1)根据上述分析可知A是Fe,B是FeCl2,C是FeCl3,D是Fe(OH)2,E是Fe(OH)3。
(2)反应③是FeCl2与Cl2反应转化为FeCl3,该反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-;
反应④是FeCl3与还原剂Fe反应产生FeCl2,该反应的离子方程式为2Fe3++Fe=3Fe2+;
反应⑦是Fe(OH)2在溶液中被空气中的O2氧化为Fe(OH)3,该反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。


科目:高中化学 来源: 题型:
【题目】恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示。已知:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-196.6 kJ/mol。
2SO3(g) ΔH=-196.6 kJ/mol。
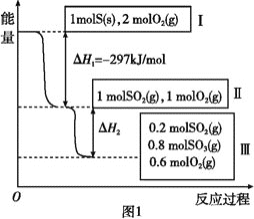
请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式:________________。
(2)状态Ⅱ到状态Ⅲ放出的热量为__________。
(3)恒温恒容时,1 mol SO2和2 mol O2充分反应,放出热量的数值比∣ΔH2∣_____(填“大”、“小”或“相等”)。
(4)将Ⅲ中的混合气体通入足量的NaOH溶液中消耗NaOH的物质的量为______,若溶液中发生了氧化还原反应,则该过程的离子方程式为:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“连翘酯苷A”是“连花清瘟胶囊”的有效成分。如图有机物是“连翘酯苷A”的水解产物,其结构简式如图所示。下列有关该有机物的说法错误的是( )
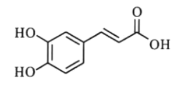
A.分子式为C9H8O4
B.分子中所有原子可能处于同一平面
C.1mol该分子最多可与5molH2发生加成反应
D.能与NaHCO3溶液反应放出CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氧化钠和过氧化钠的叙述正确的是( )
A. 氧化钠比过氧化钠稳定
B. 都能与二氧化碳、水反应产生氧气
C. 所含氧元素的化合价都为-2价
D. 阴阳离子的个数比都为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏加德罗常数的值。下列说法中正确的是( )
A.标准状况下,11.2L H2 与 11.2L D2 所含的质子数均为NA
B.1L0.1mol·L-1Fe2(SO4)3 溶液中含 Fe3+数目为 0.2 NA
C.3.2g 铜与 3.2g 硫隔绝空气加热使之充分反应,转移电子数为 0.1 NA
D.0.1mol 乙醇与 0.1mol 乙酸在一定条件下反应生成乙酸乙酯分子数为 0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用8.7g的MnO2与50mL足量的浓盐酸制取氯气
(1)求生成氯气的体积_________(标准状况)
(2)若向反应后的剩余溶液中,加入足量AgNO3溶液,生成白色沉淀57.4g,求原浓盐酸的物质的量浓度_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷在工业、农业、医学等领域用途非常广泛。回答下列问题:
⑴确定砷华(成分为 As2O3)是晶体还是非晶体,可通过______________加以确定。
⑵基态砷原子的价电子排布式为 ______________。
⑶ AsH3 空间构型为___________,NH3 沸点比 AsH3 高,其原因为__________________;药物胂凡纳明(![]() )分子中,共价键的类型有________ , 原子采用 sp2 杂化的有_____。
)分子中,共价键的类型有________ , 原子采用 sp2 杂化的有_____。
⑷砷酸(H3AsO4)的酸性比亚砷酸(H3AsO3)_______(填“强”或“弱”),其理由是 ______________。
⑸最近我国科学家研制的一种“稀磁材料”,其晶胞结构如下图所示。与 Zn 原子紧邻的 Zn 数目为_________个, 该晶体的密度为 _____________ g·cm-3(不必计算结果,写出表达式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀氨水中存在着下列平衡:NH3·H2O![]() NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是
NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是
①NH4Cl固体;②硫酸;③NaOH固体;④水;⑤加热;⑥加入少量MgSO4固体。
A. ①②③⑤ B. ③⑥ C. ③ D. ③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com