
已知三个氧化还原反应:
①2FeCl3+2KI=2FeC12+2KCl+I2 ②2FeCl2+Cl2 =2FeCl3
③2KMnO4+16HCI(浓)=2KCl+2MnCl2+8H2O+5Cl2↑
若某溶液中有Fe2+、I一、Cl—共存,要将I—氧化除去而不氧化Fe2+和Cl—,则可加入的试剂是
A. Cl2 B. KMnO4 C. FeCl3 D. HCl
科目:高中化学 来源:2016-2017学年江西省南昌市高二上学期期末考试化学试卷(解析版) 题型:简答题
(Ⅰ)部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
电离平衡常数(25 ℃) | Ka=1.77 ×10-4 | Ka=4.0 ×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(1)室温下①0.1 mol·L-1 HCOONa,②0.1 mol·L-1 NaClO,③0.1 mol·L-1 Na2CO3,④0.1 mol·L-1 NaHCO3溶液的pH由大到小的关系为______________________。
(2)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为____________________。
(3)少量CO2通入到过量的NaClO溶液中发生反应的离子方程式______________。
(4)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为__________________。
(Ⅱ)某小组运用工业上离子交换膜法制烧碱的原理,用如下图所示装置电解K2SO4溶液。
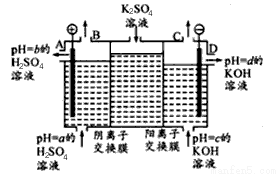
①该电解槽中通过阴离子交换膜的离子数_______(填“>”“<”或“一”)通过阳离子交换膜的离子数;
②图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为 _____________;
③电解一段时间后,B出口与C出口产生气体的质量比为______________。
查看答案和解析>>
科目:高中化学 来源:河北省2016-2017学年高一下学期开学考试化学试卷 题型:选择题
下列各离子组在指定的溶液中一定能大量共存的是 ( )
①常温在C(H+)/C(OH-)= 10-10溶液中:K+、Na+、CH3COO-、SO42﹣
②常温pH=11的溶液中:CO32﹣、Na+、AlO2﹣、NO3﹣
③水电离出的H+浓度c(H+)=10﹣12mol•L?1的溶液中:Cl﹣、NO3﹣、Na+、S2O32﹣
④使甲基橙变红色的溶液中:Fe3+、NO3﹣、Na+、SO42﹣
A. ①②③ B. ①②④ C. ②③④ D. ①③④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省高一下学期开学考试化学试卷(解析版) 题型:选择题
下列反应的离子方程式正确的是
A. 用小苏打(NaHCO3)治疗胃酸(HCl)过多:CO32-+2H+ =CO2↑+H2O
B. 氯化铁溶液腐蚀铜箔制印刷线路板:Fe3++Cu=Fe2++ Cu2+
C. 氢氧化镁溶于盐酸:Mg(OH)2+2H+= Mg2++2H2O
D. Fe3+与I-反应的离子方程式为:Fe3++2I-= Fe2++ I2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆兵团农二师华山中学高一下学期学前考试化学试卷(解析版) 题型:填空题
根据反应Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
(1)氧化产物是__________,还原产物是________。
(2)氧化剂与还原剂的物质的量之比是________。
(3)当有2 mol HNO3参加反应时,被氧化的物质是_____________ mol ,电子转移数目约为________个。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆兵团农二师华山中学高一下学期学前考试化学试卷(解析版) 题型:选择题
铁、稀盐酸、澄清石灰水、氯化铜溶液是化学中常见的物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是 ( )
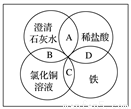
A. OH-+HCl===H2O+Cl-
B. Ca(OH)2+Cu2+===Ca2++Cu(OH)2
C. Fe+Cu2+===Cu+Fe2+
D. Fe+2H+===Fe3++H2↑
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省广州市高一上学期期期末考试化学试卷(解析版) 题型:填空题
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 、MgO、CaO等,生产工艺流程示意如下:

请回答下列问题:
(1)将菱锌矿研磨成粉的目的是:______________________________。
(2)漂白粉的有效成分是NaClO,请完成“氧化除铁”步骤中反应的离子方程式:_______________________
□Fe(OH)2+ □ClO- + □_____= □Fe(OH)3 + □ Cl-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,相对分子质量为89,化学式是____________(不用考虑化学式中各元素的排列顺序)。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为________________。
Mg(OH)2 | Zn(OH)2 | |
开始沉淀的pH | 10.4 | 6.4 |
沉淀完全的pH | 12.4 | 8.0 |
开始溶解的pH | — | 10.5 |
(5)假设各步转化均完全,分析图中数据可知:菱锌矿粉中ZnCO3的质量是_____________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省广州市高一上学期期期末考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A. Na与氧气反应因氧气用量不同,产物不同
B. Na2O和Na2O2中阳阴离子物质的量之比均为2:1
C. Na2CO3和NaHCO3的水溶液都呈碱性,它们都属于碱
D. Na2O和Na2O2都能与水反应生成对应的碱,它们都属于碱性氧化物
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三下学期期初考试化学试卷(解析版) 题型:选择题
根据侯氏制碱原理制备少量NaHCO3的实验,需经过制取NH3、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是( )
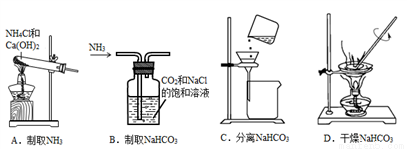
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com