
下列说法正确的是
A. Na与氧气反应因氧气用量不同,产物不同
B. Na2O和Na2O2中阳阴离子物质的量之比均为2:1
C. Na2CO3和NaHCO3的水溶液都呈碱性,它们都属于碱
D. Na2O和Na2O2都能与水反应生成对应的碱,它们都属于碱性氧化物
科目:高中化学 来源:河北省2016-2017学年高一下学期开学考试化学试卷 题型:选择题
设阿伏加德罗常数为NA,下列说法正确的是
A. 常温常压下,22.4LH2O中含有的氢原子数为2NA
B. 17gNH3与18 g H2O所含有电子数均为10NA
C. 2.7 g Al与足量的NaOH溶液反应,生成H2的分子数为0.1NA
D. 1 mol HCl气体中的分子数与2L 0.5 mol/L盐酸中的溶质粒子数相等
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆兵团农二师华山中学高一下学期学前考试化学试卷(解析版) 题型:选择题
已知三个氧化还原反应:
①2FeCl3+2KI=2FeC12+2KCl+I2 ②2FeCl2+Cl2 =2FeCl3
③2KMnO4+16HCI(浓)=2KCl+2MnCl2+8H2O+5Cl2↑
若某溶液中有Fe2+、I一、Cl—共存,要将I—氧化除去而不氧化Fe2+和Cl—,则可加入的试剂是
A. Cl2 B. KMnO4 C. FeCl3 D. HCl
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省广州市高一上学期期期末考试化学试卷(解析版) 题型:选择题
下列实验能达到预期目的的是
编号 | 实验内容 | 实验目的 |
A | 向某待测液中通入Cl2 ,再滴入2滴KSCN溶液后,溶液变为血红色 | 证明该待测液中一定含有Fe2+ |
B | 向某待测液中加入盐酸,产生能使澄清石灰水变浑浊的气体 | 证明该待测液中一定含有CO32- |
C | 把硫酸酸化的H2O2溶液滴入FeCl2溶液中,溶液变成黄色 | 证明H2O2氧化性大于Fe3+ |
D | 向Al(0H)3沉淀中分别加入盐酸和氨水,沉淀都会溶解 | 证明Al(0H)3是两性氢氧化物 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省广州市高一上学期期期末考试化学试卷(解析版) 题型:选择题
下列实验现象正确的是
A. 向稀的Na2CO3和NaHCO3溶液中加入CaCl2溶液均有白色沉淀产生
B. Na2CO3和NaHCO3溶液中加入澄清石灰水均有白色沉淀产生
C. CCl4萃取碘水中的碘单质后,液体分层,紫红色在上层
D. 将足量Na2O2投入FeCl2溶液中, 有气泡产生并最终得到白色沉淀
查看答案和解析>>
科目:高中化学 来源:2017届广西省高三2月月考理综化学试卷(解析版) 题型:填空题
医用氯化钙可用于生产补钙、抗过敏和消炎等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2、2H2O的质量分数为97.0%~103.0%)的主要流程如下:

已知:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Al(OH)3 | |
开始沉淀时的pH | 2.3 | 4.0 | 开始溶解时的pH | 7.8 |
完全沉淀时的pH | 3.7 | 5.2 | 完全溶解时的pH | 10.8 |
(1)CaCO3与盐酸反应的离子方程式___________。
(2)“除杂”操作是加入氢氧化钙,调节溶液的pH范围为________,目的是除去溶液中的少量Al3+、Fe2+。
(3)过滤时需用的比玻璃器有__________。
(4)“酸化”操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①防止氢氧化钙吸收空气中的二氧化碳;②防止Ca2+在蒸发时水解;③_______。
(5)蒸发结晶要保持在160℃的原因是__________。
(6)测定样品中Cl-含量的方法是:称取0.750 0 gCaCl2·2H2O样品,溶解,在250 mL容量瓶中定容;量取25.00 mL待测溶液于锥形瓶中;用0.050 00 mol/L AgNO3溶液滴定至终点(用K2Cr2O2),消耗AgNO3溶液体积的平均值为20.39 mL。
①上述测定过程中需用溶液润洗的仪器有________。
②计算上述样品中CaCl2·2H2O的质量分数为_______。(保留四位有效数字)
③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有________;__________。
查看答案和解析>>
科目:高中化学 来源:2017届广西省高三2月月考理综化学试卷(解析版) 题型:选择题
我国古代科技高度发达,下列有关古代文献的说法,错误的是
A. 晋代葛洪的《抱朴子》记载“丹砂烧之成水银,积变又成丹砂”,是指加热时丹砂(HgS)熔融成液态,冷却时重新结晶为HgS晶体
B. 汉朝的《淮南万毕术》、《神农本草经》记载“白青(碱式碳酸铜)得铁化为铜”,“石胆…能化铁为铜”都是铜可以用铁来冶炼
C. 清初《泉州府志》物产条载:“初,人不知盖泥法,元时南安有黄长者为宅煮糖,宅垣忽坏,去土而糖白,后人遂效之。”该段文字记载了蔗糖的分离提纯采用了黄泥来吸附红糖中的色素
D. 明朝的《本草纲目》记载“烧酒非古法也,自元时创始,其法用浓酒和糟入甑(指蒸锅),蒸令气上,用器承滴露。”该段文字记载了白酒(烧酒)的制造过程中采用了蒸馏的方法来分离和提纯
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三下学期期初考试化学试卷(解析版) 题型:填空题
以NaCl等为原料制备KClO4的过程如下:
①在无隔膜、微酸性条件下,发生反应:NaCl+H2O—NaClO3+H2↑(未配平)
②在NaClO3溶液中加入KCl发生复分解反应,降温结晶,得KClO3。
③一定条件下反应:4KClO3=3KClO4+KCl,将产物分离得到KClO4。
(1)电解时,产生质量为2.13g NaClO3,同时得到H2的体积为____________L(标准状况)。
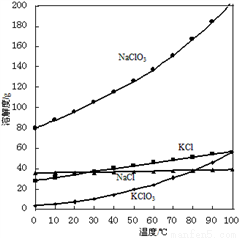
(2)向NaClO3溶液中加入KCl能得到KClO3的原因是________________。
(3)该过程制得的KClO4样品中含少量KCl杂质,为测定产品纯度进行如下实验:
准确称取5.689g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使ClO4-全部转化为Cl- (反应为:3 KClO4 +C6H12O6 ═ 6 H2O + 6 CO2↑ + 3 KCl),加入少量K2CrO4溶液作指示剂,用0. 20mol/L AgNO3溶液进行滴定至终点,消耗AgNO3溶液体积21.00mL。滴定达到终点时,产生砖红色Ag2CrO4沉淀。
① 已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.1×10-12,若c(CrO42-)=1.1×10-4mol/L,则此时c(Cl-)=________________mol/L。
② 计算KClO4样品的纯度(请写出计算过程。)______________________________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市高一下学期分班考试化学试卷(解析版) 题型:填空题
按要求填空:
(1)将质量比为7∶15的N2和NO混合,则混合气体中N2和NO的物质的量之比为______;氮原子和氧原子的个数之比为_______ ;22克该混合气体在标准状况下的体积为_________。
(2)在氯化镁和硫酸镁的混合液中,若Mg2+与Cl-的物质的量浓度之比为4∶3时,则.Mg2+与SO 物质的量浓度之比为______。
物质的量浓度之比为______。
(3)将8g铁片放入100mL硫酸铜溶液中,溶液中的Cu2+全部被还原时,“铁片”变为8.4g,则原c(CuSO4)为___________mol/L 。
(4)使4.48 L CO2气体迅速通过Na2O2固体后得到3.36 L(标准状况下)气体,这3.36 L气体的质量是 _________ g 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com