(2010?南京二模)(1)在一定条件下,将1mol N
2与3mol H
2混合于一个10L密闭容器中,反应在不同温度下达到平稳时NH
3的浓度如图1所示.其中,温度为T
1时平稳混合气体中氨的体积分数为25%.
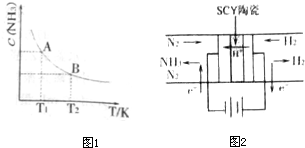
①当温度由T
1变化到T
2时,平稳常数K
A>
>
K
B(填“>”、“<”或“=”)
②T
1温度达到平衡时N
2的转化率为
40%
40%
.
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N
2在催化剂(掺有少量Fe
2O
3的TiO
2)表面与水发生下列反应:2N
2(g)+6H
2O(l)?4NH
3(g)+3O
2(g)此反应的△S
>
>
0(填“>”、“<”或“=”)△H
+1530kJ/mol
+1530kJ/mol
.
(已知:N
2(g)+3H
2(g)?2NH
3(g)△=-92.44kJ/mol2H
2(g)+O
2(g)?2H
2O(l)△H=-571.6kJ/mol)
(3)科学家采用高质子导电性的SCY陶瓷(可传递H
+),实现了低温常压下高转化率的电化学合成氨,其实验原理如图2所示,则阴极的电极反应式为
N2+6e-+6H+=2NH3
N2+6e-+6H+=2NH3
.


 2NH3(g)
2NH3(g)

 阅读快车系列答案
阅读快车系列答案