
下表给出了五种元素的相关信息,其中A、B、C、D为短周期元素.
| 元素 | 相关信息 |
| A | 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为倍受青睐的清洁燃料. |
| B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障. |
| C | 植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂. |
| D | 室温下其单质呈粉末状固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰. |
| E | 它是人体不可缺少的微量元素,其单质也是工业生产中不可缺少的金属原材料,常用于制造桥梁、轨道等. |
根据上述信息填空:
(1)B在元素周期表中的位置是
(2)D的单质与烧碱水溶液加热时自身的氧化还原反应生成两种具有强还原性的阴离子,写出该反应的离子方程式 .
(3)C与A形成的化合物X,分子中原子个数比为1:2;相同条件时,相同质量时,氢气的体积为X气体体积的16倍;分子中有极性键和非极性键,可作火箭燃料.写出X分子的结构式
(4)以上这五种元素能组成一种工业上用途极广的复盐(类似明矾,含一种阴离子和两种阳离子),该物质中的A、B、C、D、E的质量比为5:56:7:16:14.请写出该化合物的化学式 .
考点:
元素周期律和元素周期表的综合应用.
专题:
元素周期律与元素周期表专题.
分析:
A、B、C、D为短周期元素,氢气的燃烧产物为水,是倍受青睐的清洁燃料,则A为H;分离液态空气可得到氮气和氧气,臭氧能保护地球地表环境,则B为O;由植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂为NO,则C为N;室温下其单质呈粉末状固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰,则D为S;由E为人体不可缺少的微量元素,其单质也是工业生产中不可缺少的金属原材料,常用于制造桥梁、轨道等,则E为Fe,然后利用元素及其单质、化合物的性质来解答.
解答:
解:A、B、C、D为短周期元素,氢气的燃烧产物为水,是倍受青睐的清洁燃料,则A为H;分离液态空气可得到氮气和氧气,臭氧能保护地球地表环境,则B为O;由植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂为NO,则C为N;室温下其单质呈粉末状固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰,则D为S;由E为人体不可缺少的微量元素,其单质也是工业生产中不可缺少的金属原材料,常用于制造桥梁、轨道等,则E为Fe,
(1)氧元素位于元素周期表中第二周期第VIA族,故答案为:第二周期第VIA族;
(2)硫单质与碱反应生成两种具有强还原性的阴离子,阴离子为SO32﹣、S2﹣,该离子反应为3S+6OH﹣ SO32﹣+2S2﹣+3H2O,
SO32﹣+2S2﹣+3H2O,
故答案为:3S+6OH﹣ SO32﹣+2S2﹣+3H2O;
SO32﹣+2S2﹣+3H2O;
(3)相同条件时,相同质量时,氢气的体积为X气体体积的16倍,则X的相对分子质量为16×2=32,设化学式为NxH2x,则14x+2x=32,解得x=2,
分子中有极性键和非极性键,则X分子的结构式为 ,故答案为:
,故答案为: ;
;
(4)物质中的A、B、C、D、E的质量比为5:56:7:16:14,
则原子个数之比为 :
: :
: :
: :
: =20:14:2:2:1,五种元素形成的阳离子应为铵根离子和亚铁离子,
=20:14:2:2:1,五种元素形成的阳离子应为铵根离子和亚铁离子,
类似明矾,含有结晶水,则该物质的化学式为(NH4)2Fe(SO4)2•6H2O,故答案为:(NH4)2Fe(SO4)2•6H2O.
点评:
本题考查元素周期表和元素周期律,熟悉元素及物质的性质是解答本题的关键,难度较大,(4)是学生解答中的难点,注意与明矾的组成相似来分析.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
室温下,现有三种酸,a盐酸、b乙酸、c硫酸的稀溶液,下列说法正确的是( )
|
| A. | 同浓度,pH由大到小:c>a>b |
|
| B. | 同浓度同体积,分别与氢氧化钠中和,所需的氢氧化钠的物质的量由大到小:c>a>b |
|
| C. | 同pH,物质的量浓度由大到小:b>a>c |
|
| D. | 同pH同体积,分别于少量且质量相同的Zn片反应,反应所需时间由长到短:b>a>c |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 1 mol葡萄糖能水解生成2 mol CH3CH2OH和2 mol CO2 |
|
| B. | 在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀 |
|
| C. | 油脂不是高分子化合物,1 mol油脂完全水解生成1 mol甘油和3 mol高级脂肪酸 |
|
| D. | 欲检验蔗糖水解产物是否具有还原性,可向水解后的溶液中直接加入新制的Cu(OH)2悬浊液并加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在可逆反应:2NO2(g)⇌2NO(g)+O2(g),在体积不变的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态.
|
| A. | ①④ | B. | ②③⑤ | C. | ①③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与金属腐蚀有关的说法正确的是( )
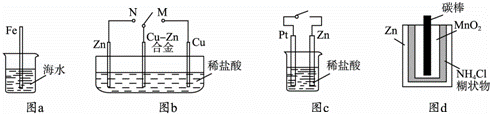
|
| A. | 图a中,插入海水中的铁棒,越靠近底端腐蚀越严重 |
|
| B. | 图b中,开关由M改置于N时,Cu﹣Zn合金的腐蚀速率减小 |
|
| C. | 图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 |
|
| D. | 图d中,Zn﹣MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定量的CO2气体通入500mL某NaOH溶液中,充分反应后,将溶液在低温进蒸发,得到不含结晶水的白色固体A.取三份质量不同的A样品分别与50mL相同浓度的盐酸反应,得到气体的体积(标准状况)与固体A的质量关系职下表所示:
| 组 别 | ① | ② | ③ |
| 盐酸体积(mL) | 50 | 50 | 50 |
| A的质量 (g) | 3.80 | 5.70 | 7.60 |
| 气体体积(mL) | 896 | 1344 | 1344 |
(1)上表中第 组数据加入的50mL盐酸的反应后有剩余,
(2)试推断:A的成份为
(3)盐酸的物质的量的浓度为 mol•L﹣1.
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙为单质,它们的转化关系如下图所示(某些条件和部分产物已略去)。下列说法不正确的是

A.若甲既能与盐酸反应又能与NaOH溶液反应,则丙可能属于两性氧化物
B.若甲为短周期中原子半径最大的主族元素的单质,且戊为碱,则丙可能为Na2O2
C.若丙、丁混合产生白烟,且丙分子为18电子分子,丁分子为10电子分子,则乙的水溶液可能具有漂白作用
D.若甲、丙、戊含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序一定为:甲<丙<戊
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com