
(6分)将足量的锌投入200mL某浓度的盐酸中完全反应,生成的H2在标准状况下体积为1.12L。求:
(1)参加反应的锌的质量是多少?
(2)所用盐酸中HCl的物质的量浓度?
(6分)3.25g,0.5mol/L
【解析】
试题分析:(1)标准状况下氢气的物质的量是1.12L÷22.4L/mol=0.05mol,则根据方程式Zn+2HCl=ZnCl2+H2↑可知,消耗锌的物质的量是0.05mol,其质量是0.05mol×65g/mol=3.25g。
(2)根据氢原子守恒或反应的方程式可知,盐酸中氯化氢的物质的量是0.05mol×2=0.1mol,则盐酸的浓度是0.1mol÷0.2L=0.5mol/L。
考点:考查物质的量的有关计算
点评:在进行物质的量的有关计算时,关键是熟练应用几个关系式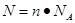 、n=m/M、
、n=m/M、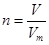 、
、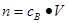 ,特别还要注意气体摩尔体积的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。另外如果是根据反应的方程式进行的有关计算,还需要写出有关的方程式,然后找出已知量和未知量之间的关系,列式计算即可。
,特别还要注意气体摩尔体积的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。另外如果是根据反应的方程式进行的有关计算,还需要写出有关的方程式,然后找出已知量和未知量之间的关系,列式计算即可。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| m |
| M |
| m |
| M |
| 2mNA |
| M |
| 2mNA |
| M |
| 22.4m |
| M |
| 22.4m |
| M |
查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)实验室常用的浓盐酸密度为1.17 g·mL-1,质量分数为36.5%。
(1) 此浓盐酸的物质的量浓度为_________。
(2) 取此浓盐酸50 mL,用蒸馏水稀释到200 mL,稀释后盐酸的物质的量浓度为_________。
(3) 将13 g锌投入足量的上述实验所得的稀盐酸中,充分反应后,
① 放出的H2在标准状况下的体积为_______。
② 将生成的H2通过足量的灼热CuO,则被还原出的铜的质量为______ (假设氢气在反应中没有损失)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山西省大同一中高一上学期期中考试化学试卷 题型:填空题
(8分)实验室常用的浓盐酸密度为1.17 g·mL-1,质量分数为36.5%。
(1) 此浓盐酸的物质的量浓度为_________。
(2) 取此浓盐酸50 mL,用蒸馏水稀释到200 mL,稀释后盐酸的物质的量浓度为_________。
(3) 将13 g锌投入足量的上述实验所得的稀盐酸中,充分反应后,
① 放出的H2在标准状况下的体积为_______。
② 将生成的H2通过足量的灼热CuO,则被还原出的铜的质量为______ (假设氢气在反应中没有损失)。
查看答案和解析>>
科目:高中化学 来源:2014届山西省高一上学期期中考试化学试卷 题型:填空题
(8分)实验室常用的浓盐酸密度为1.17 g·mL-1,质量分数为36.5%。
(1) 此浓盐酸的物质的量浓度为_________。
(2) 取此浓盐酸50 mL,用蒸馏水稀释到200 mL,稀释后盐酸的物质的量浓度为_________。
(3) 将13 g锌投入足量的上述实验所得的稀盐酸中,充分反应后,
① 放出的H2在标准状况下的体积为_______。
② 将生成的H2通过足量的灼热CuO,则被还原出的铜的质量为______ (假设氢气在反应中没有损失)。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)(6分)将6.50 g锌投入200 mL某浓度的盐酸中,锌和盐酸恰好完全反应。
求:①所用盐酸中HCl的物质的量浓度 ②反应中生成的H2在标准状况下的体积。
![]() (2)(8分)取含MnO2的软锰矿石27.86g跟足量浓盐酸反应(杂质不参与反应),制得17.75gCl2(标准状况),反应原理如下:
(2)(8分)取含MnO2的软锰矿石27.86g跟足量浓盐酸反应(杂质不参与反应),制得17.75gCl2(标准状况),反应原理如下:
MnO2+4HCl(浓)==== MnCl2+Cl2↑+2H2O
求: ①这种软锰矿石中MnO2的百分含量。
② 被氧化的HCl的物质的量。
③ 此时转移的电子的物质的量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com