
氨气是生产化肥、硝酸等的重要原料,围绕合成氨人们进行了一系列的研究
(1)氢气既能与氮气又能与氧气发生反应,但是反应的条件却不相同。
已知:2H2 (g) + O2 (g) = 2H2O (g) ΔH = -483.6 kJ/mol
3H2 (g) + N2 (g)  2NH3 (g) ΔH =
-92.4 kJ/mol
2NH3 (g) ΔH =
-92.4 kJ/mol
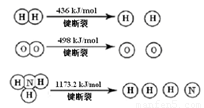
计算断裂1 mol N≡N键需要能量 kJ , 氮气分子中化学键比氧气分子中的化学键键 (填“强”或“弱”),因此氢气与二者反应的条件不同。
(2)固氮是科学家致力研究的重要课题。自然界中存在天然的大气固氮过程:N2 (g) + O2 (g) = 2NO (g) ΔH = +180.8 kJ/mol ,工业合成氨则是人工固氮。
分析两种固氮反应的平衡常数,下列结论正确的是 。
|
反应 |
大气固氮 |
工业固氮 |
||||
|
温度/℃ |
27 |
2000 |
25 |
350 |
400 |
450 |
|
K |
3.84×10-31 |
0.1 |
5×108 |
1.847 |
0.507 |
0.152 |
A.常温下,大气固氮几乎不可能进行,而工业固氮非常容易进行
B.人类大规模模拟大气固氮是无意义的
C.工业固氮温度越低,氮气与氢气反应越完全
D.K越大说明合成氨反应的速率越大
(3)在恒温恒容密闭容器中按照甲、乙、丙三种方式分别投料, 发生反应:3H2
(g) + N2 (g)  2NH3
(g)测得甲容器中H2的转化率为40%。
2NH3
(g)测得甲容器中H2的转化率为40%。
|
|
N2 |
H2 |
NH3 |
|
甲 |
1 |
3 |
0 |
|
乙 |
0.5 |
1.5 |
1 |
|
丙 |
0 |
0 |
4 |
判断乙容器中反应进行的方向 。(填“正向”或“逆向”)
达平衡时,甲、乙、丙三容器中NH3的体积分数大小顺序为 。
(4)氨气是合成硝酸的原料,写出氨气与氧气反应生成一氧化氮和气态水的热化学方程式 。
(9分)
(1)946 kJ/mol (2分) 强(1分)
(2)BC(2分,少选得1分,多选错选不得分)
(3)①逆向(1分) ② 丙>甲=乙(1分)
(4)4NH3(g) + 5NO(g) = 4NO(g) + 6H2O(g) ΔH= -904.4kJ/mol (2分) (化学反应书写正确得1分,ΔH正确得1分)
【解析】
试题分析:
(1)断裂3 molH-H键需要能量436×3kJ与断裂1 mol N≡N键需要能量和减去形成2molNH3放出能量的差值为-92.4 kJ/mol ,可知断裂1 mol N≡N键需要能量946 kJ/mol;根据键能的大小可知氮气分子中化学键比氧气分子中的化学键键强。
(2)A.常温下,根据平衡常数大气固氮几乎不可能进行,而工业固氮虽然平衡常数大,不代表反应容易进行,错误;B.大气固氮反应程度很小,所以人类大规模模拟大气固氮是无意义的,正确;C.工业固氮温度越低,K越大,氮气与氢气反应越完全,正确;D.K越大说明合成氨反应程度很大,而不表示速率越大,错误。
(3)①根据转化率可知甲在建立平衡时各物质量分别为1.8,0.6,0.8,对比乙数据知乙中方向为逆向;② 甲乙为等效平衡,NH3的体积分数相同,丙的物料相当于甲乙的两倍,压强增大平衡正移,NH3的体积分数最大大,得:丙>甲=乙(1分)
(4)根据反应为:
①2H2 (g) + O2 (g) = 2H2O (g) ΔH = -483.6 kJ/mol
②3H2
(g) + N2 (g)  2NH3 (g) ΔH =
-92.4 kJ/mol
2NH3 (g) ΔH =
-92.4 kJ/mol
③N2 (g) + O2 (g) = 2NO (g) ΔH = +180.8 kJ/mol,
由①×3-②×2+③×2得4NH3(g) + 5NO(g) = 4NO(g) + 6H2O(g) ΔH= -904.4kJ/mol
考点:考查化学键、键能、化学平衡,盖斯定律等相关知识。


科目:高中化学 来源:2012-2013学年北京市房山区房山中学高二下学期期中考试化学试卷(带解析) 题型:填空题
氨气是生产化肥、硝酸的重要原料,围绕合成氨人们进行了一系列的研究
(1)氢气既能与氮气又能与氧气发生反应,但是反应的条件却不相同。
已知:2H2 (g) + O2 (g) = 2H2O (g) ΔH =" -483.6" kJ/mol
3H2 (g) + N2 (g)  2NH3 (g) ΔH =" -92.4" kJ/mol
2NH3 (g) ΔH =" -92.4" kJ/mol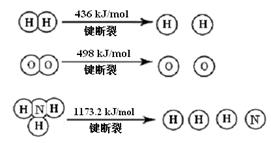
计算断裂1 mol N≡N键需要能量 kJ , 氮气分子中化学键比氧气分子中的 化学键键 (填“强”或“弱”),
(2)固氮是科学家致力研究的重要课题。自然界中存在天然的大气固氮过程:
N2 (g) + O2 (g) =" 2NO" (g) ΔH =" +180.8" kJ/mol ,工业合成氨则是人工固氮。
分析两种固氮反应的平衡常数,下列结论正确的是 。
| 反应 | 大气固氮 | 工业固氮 | ||||
| 温度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
 2NH3 (g)测得甲容器中H2的转化率为40%。
2NH3 (g)测得甲容器中H2的转化率为40%。| | N2 | H2 | NH3 |
| 甲 | 1 | 3 | 0 |
| 乙 | 0.5 | 1.5 | 1 |
| 丙 | 0 | 0 | 4 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省稳派名校学术联盟高三12月调研考试理综化学试卷(解析版) 题型:填空题
氨有着广泛的用途,可用于化肥、硝酸、合成纤维等工业生产。
(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应可生成氨气:

该反应在固定体积的密闭容器中进行,有关说法正确的是_____________(填序号字母)。
A.反应处于平衡状态时,
B.反应达到平衡后,
C.体系的总压强不变,说明反应已达平衡
D.混合气体的密度保持不变,说明反应已达平衡
(2)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧试验机中相关的反应有:
 ①
①
 ②
②
 ③
③
请写出上述三个反应中 、
、 、
、 三者之间关系的表达式,
三者之间关系的表达式, =_________。
=_________。
(3)工业制硝酸的主要反应是:
 =
=
①升高温度,反应的K值减小,则Q______(填“>”、“<”或“=”)0。
②若反应起始的物质的量相同,下列关系图错误的是________(填序号)。


③在容积固定的密闭容器中发生上述反应,容器内部分物质的浓度如下表:
|
时间/浓度 |
|
|
|
|
|
起始 |
4.0 |
5.5 |
0 |
0 |
|
第2min |
3.2 |
a |
0.8 |
1.2 |
|
第4min |
2.0 |
3.0 |
2.0 |
3.0 |
|
第6min |
2.0 |
3.0 |
2.0 |
3.0 |
反应在第2 min到第4 min时,O2的平均反应速率为________。
反应在第2 min时改变了条件,改变的条件可能是______________________________。
该条件下,反应的平衡常数K=________。
查看答案和解析>>
科目:高中化学 来源:2014届北京市高二下学期期中考试化学试卷(解析版) 题型:填空题
氨气是生产化肥、硝酸的重要原料,围绕合成氨人们进行了一系列的研究
(1)氢气既能与氮气又能与氧气发生反应,但是反应的条件却不相同。
已知:2H2 (g) + O2 (g) = 2H2O (g) ΔH =" -483.6" kJ/mol
3H2 (g) + N2 (g)  2NH3 (g) ΔH =" -92.4"
kJ/mol
2NH3 (g) ΔH =" -92.4"
kJ/mol

计算断裂1 mol N≡N键需要能量 kJ , 氮气分子中化学键比氧气分子中的 化学键键 (填“强”或“弱”),
(2)固氮是科学家致力研究的重要课题。自然界中存在天然的大气固氮过程:
N2 (g) + O2 (g) =" 2NO" (g) ΔH =" +180.8" kJ/mol ,工业合成氨则是人工固氮。
分析两种固氮反应的平衡常数,下列结论正确的是 。
|
反应 |
大气固氮 |
工业固氮 |
||||
|
温度/℃ |
27 |
2000 |
25 |
350 |
400 |
450 |
|
K |
3.84×10-31 |
0.1 |
5×108 |
1.847 |
0.507 |
0.152 |
A.常温下,大气固氮几乎不可能进行,而工业固氮非常容易进行
B.人类大规模模拟大气固氮是无意义的
C.工业固氮温度越低,氮气与氢气反应越完全
D.K越大说明合成氨反应的速率越大
(3)在恒温恒容密闭容器中按照甲、乙、丙三种方式分别投料, 发生反应:
3H2 (g) + N2 (g)  2NH3 (g)测得甲容器中H2的转化率为40%。
2NH3 (g)测得甲容器中H2的转化率为40%。
|
|
N2 |
H2 |
NH3 |
|
甲 |
1 |
3 |
0 |
|
乙 |
0.5 |
1.5 |
1 |
|
丙 |
0 |
0 |
4 |
①判断乙容器中反应进行的方向 。(填“正向”或“逆向”)
②达平衡时,甲、乙、丙三容器中NH3的体积分数大小顺序为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上通过氮气和氢气反应合成氨,氨经一系列反应可以得到硝酸。反应如下图所示:
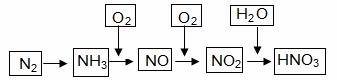 |
请回答:
(1)NO2与H2O反应中的还原剂是 。
(2)NH3与O2制取NO的化学反应方程式 。
(3)下列说法不正确的是(选填序号字母) 。
a.氨可用作制冷剂
b.铵态氮肥一般不能与碱性化肥共同使用
c.硝酸可用于制化肥、农药、炸药、染料、盐类等
d.某浓硝酸中含有溶质2mol,标准状况下,该浓硝酸与足量的铜完全反应能生成1mol NO2
(4)大量排放含N、P化合物的废水,会导致水体污染。其中含氮的物质主要是蛋白质,蛋白质在水中分解会产生氨气,氨气在微生物的作用下与氧气反应生成HNO2,上述氨气与氧气的反应中,氧化剂与还原剂的物质的量之比为 。
(5)已知:
H2(g) + ![]() O2(g) = H2O(g) △H1 = 241.8 kJ/mol
O2(g) = H2O(g) △H1 = 241.8 kJ/mol
![]() N2(g) + O2(g) = NO2 (g) △H2 = +33.9 kJ/mol
N2(g) + O2(g) = NO2 (g) △H2 = +33.9 kJ/mol
![]() N2(g) +
N2(g) + ![]() H2(g) = NH3 (g) △H3 = 46.0kJ/mol
H2(g) = NH3 (g) △H3 = 46.0kJ/mol
则17g氨气与氧气反应生成NO2(g)与H2O(g)时,△H= kJ/mol。
(6)氨气是氮肥工业的重要原料,某化肥厂生产铵态氮肥(NH4) 2SO4的工艺流程如下:
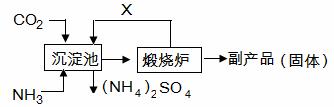 |
向装有CaSO4悬浊液的沉淀池中先通氨气,再通CO2的原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com