
| A、原混合物含0.1molFe |
| B、原混合物的质量可能大于8.8g |
| C、生成物中含0.1molFeS |
| D、加热后的混合物由FeS、Fe组成 |
| 2.24L |
| 22.4L/mol |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 高炉炼铁中发生的基本反应之一如下:FeO(固)+CO(气)?Fe(固)+CO2(气)(△H>0).
高炉炼铁中发生的基本反应之一如下:FeO(固)+CO(气)?Fe(固)+CO2(气)(△H>0).查看答案和解析>>
科目:高中化学 来源: 题型:
 汽车尾气净化器中的主要反应为:2NO(g)+2CO(g)
汽车尾气净化器中的主要反应为:2NO(g)+2CO(g)| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
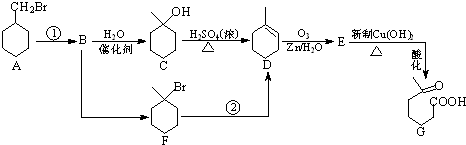
 、且属于酯类的同分异构体:
、且属于酯类的同分异构体:
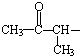
 )也可以发生“Diels-Alder反应”,该化学反应方程式为:
)也可以发生“Diels-Alder反应”,该化学反应方程式为:查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | CH3OH的体积分数/% |
| 810 | a |
| 915 | 10.0 |
| 1000 | b |
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀,若用如图所示实验装置可制得纯净的Fe(OH)2沉淀.两极材料分别为石墨和铁.
由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀,若用如图所示实验装置可制得纯净的Fe(OH)2沉淀.两极材料分别为石墨和铁.查看答案和解析>>
科目:高中化学 来源: 题型:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 几种常见物质之间存在如图转化关系,其中X、Y、Z为单质,且X为生活中最常用金属,其他物质均为化合物.已知Y 为无色无味气体,E 为无色有刺激性气味气体,能使品红溶液退色,G溶液呈黄色,它们之间(部分产物及条件略去).请回答下列问题:
几种常见物质之间存在如图转化关系,其中X、Y、Z为单质,且X为生活中最常用金属,其他物质均为化合物.已知Y 为无色无味气体,E 为无色有刺激性气味气体,能使品红溶液退色,G溶液呈黄色,它们之间(部分产物及条件略去).请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com