
| A. | 铁表面涂油漆可增强其抗腐蚀性 | |
| B. | PM2.5是指大气中直径接近2.5×10-6m的颗粒,分散在空气中形成胶体 | |
| C. | 大量燃烧煤、石油等化石燃料是造成雾霾天气的一种重要因素 | |
| D. | 含重金属离子的电镀废液不能随意排放 |
分析 A.在钢铁表面涂油漆可以使铁与水和氧气隔绝;
B.PM2.5是微粒直径为2.5微米的颗粒,1微米=1000nm,结合胶体微粒直径大小分析;
C.大量燃烧化石燃料可产生有害气体和烟尘;
D.重金属离子有毒.
解答 解:A.在钢铁表面涂油漆可以使铁与水和氧气隔绝,能防止铁生锈,故A正确;
B.PM2.5是微粒直径为2.5微米的颗粒,1微米=1000nm,“PM2.5”是细小颗粒物悬浮在空气中形成不是胶体,故B错误;
C.大量燃烧化石燃料可产生有害气体和烟尘,是造成雾霾天气的一种重要因素,故C正确;
D.重金属离子有毒,含重金属离子的电镀废液不能随意排放,故D正确.
故选B.
点评 本题考查金属腐蚀、环境污染及治理,为高频考点,侧重于化学与生活、生产、能源与环境的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大,注意相关基础知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | 钠保存在煤油里的原因之一是它极易与氧气反应 | |
| B. | 铝在空气中很容易燃烧 | |
| C. | 镁表面的氧化膜疏松,不能保护内层金属 | |
| D. | 铁锈的主要成分是Fe3O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 维生素C不具有还原性 | |
| B. | 上述过程中砷元素发生还原反应 | |
| C. | 上述过程中+5价砷类物质作还原剂 | |
| D. | 1 mol+5价砷完全转化为+3价砷,共失去2 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳和二氧化碳 | B. | 1mol 碳和3mol 碳 | ||
| C. | 3mol C2H2和1mol C6H6 | D. | 淀粉和纤维素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用图1所示装置除去CO2中含有的少量HCl | |
| B. | 用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 | |
| C. | 用图3所示装置制取少量纯净的CO2气体 | |
| D. | 用图4所示装置高温煅烧石灰石 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
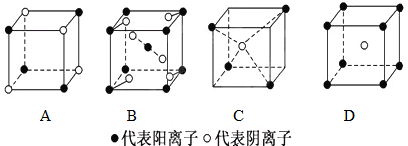
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
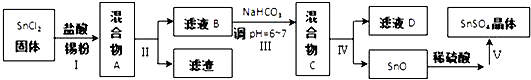
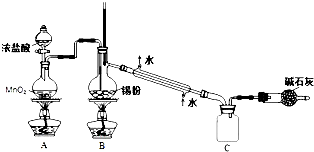
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com