
(1)含酚酞的Na2CO3溶液溶液显红色的原因为(用离子方程式解释).
(2)Na2S溶液中离子浓度由大到小的顺序为 ,向该溶液中加入少量固体CuSO4,溶液pH_(填“增大”、“减小”或“不变”).
(3)配制FeSO4溶液要加入
(4)明矾可作净水剂,原理为(用离子方程式解释)
考点: 盐类水解的应用;盐类水解的原理.
分析: (1)碳酸根离子水解溶液显碱性;
(2)硫化钠溶液中硫离子分步水解分析离子浓度大小;
(3)硫酸亚铁易氧化和水解,加入铁防氧化,加入硫酸防止水解;
(4)明矾净水石铝离子水解生成了氢氧化铝胶体,具有吸附悬浮杂质的作用.
解答: 解:(1)含酚酞的Na2CO3溶液溶液显红色的原因,是碳酸根离子水解溶液显碱性,反应的离子方程式为CO32﹣+H2O⇌HCO3﹣+OH﹣;
故答案为:CO32﹣+H2O⇌HCO3﹣+OH﹣;
(2)硫化钠溶液中硫离子分步水解,S2﹣+H2O⇌HS﹣+OH﹣,HS﹣+H2O⇌H2S+OH﹣,溶液中离子浓度大小为:c(Na+)>c(S2﹣)>c(OH﹣)>c(HS﹣)>c(H+),向该溶液中加入少量固体CuSO4,发生反应的离子方程式为:Cu2++S2﹣=CuS↓,氢氧根离子浓度减小,溶液PH减小;
故答案为:(Na+)>c(S2﹣)>c(OH﹣)>c(HS﹣)>c(H+);减小;
(3)硫酸亚铁易氧化和水解,加入铁防氧化,加入硫酸防止水解,配制FeSO4溶液;
故答案为:铁粉和硫酸;
(4)明矾净水石铝离子水解生成了氢氧化铝胶体,具有吸附悬浮杂质的作用,反应的离子方程式为:Al3++3H2O⇌Al(OH)3(胶体)+3H+;
故答案为:Al3++3H2O⇌Al(OH)3(胶体)+3H+.
点评: 本题考查了盐类水解的分析判断,电解质溶液中离子浓度大小的比较,盐类水解的应用分析,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:
下图是元素周期表的一部分
| ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ||||||||||||||
| ⑥ | ⑦ | ⑧ | |||||||||||||||
| ⑨ | ⑩ |
(1)写出元素⑨的基态原子的价电子排布式________,元素⑩的原子结构示意图___________。焊接钢轨时,常利用⑩的某些氧化物与⑦的单质在高温下发生反应,试写出其中一种反应的化学方程式__ 。
(2)①③⑤三种元素可以形成多种有机化合物分子,其中最简单原子数最少的
一种是室内装潢时形成的主要气体污染物。试写出它的电子式_ ,根据价层电子对互斥(VSEPR)理论推测该分子的空间构型为__ 。
(3)元素④的氢化物的分子立体构型为_________,中心原子的杂化方式______。
③④⑤三种元素的第一电离能大小关系是_____ ____(填元素符号)、电负性大小关系是 _________ (填元素符号)。
(4)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与盐酸溶液反应的化学方程式:
。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列过程能使蛋白质变性的是K( )
|
| A. | 蛋白质中加Na2SO4后析出蛋白质 |
|
| B. | 蛋白质用福尔马林浸泡 |
|
| C. | 蛋白质中加Pb(Ac)2后析出蛋白质固体 |
|
| D. | 蛋白质中遇X光后 |
查看答案和解析>>
科目:高中化学 来源: 题型:
温度一定时,于密闭容器中发生可逆反应:mA(气)+nB(气)  pC(气),达到平衡后,若将混合气体的体积压缩到原来的
pC(气),达到平衡后,若将混合气体的体积压缩到原来的 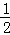 ,当再次达到平衡时,C的浓度为原平衡时C的浓度的1.9 倍,则下列叙述中正确的是()
,当再次达到平衡时,C的浓度为原平衡时C的浓度的1.9 倍,则下列叙述中正确的是()
A. 平衡向逆反应方向移动 B. C气体的体积分数增大
C. 气体A的转化率升高 D. m+n>p
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,下列叙述正确的是()
A. 60g SiO2中含有NA个SiO2分子
B. 标准状况下,2.24L NH3和CH4的混合气体,所含电子总数为2NA
C. 1mol CO2与含1mol NaOH的溶液反应后,溶液中HCO3﹣数为NA
D. 1mol C5H12分子中共价键总数为16NA
查看答案和解析>>
科目:高中化学 来源: 题型:
塑化剂又称增塑剂,是一种增加材料的柔软性或使材料液化的添加剂,不能用于食品、酒类等行业.
已知:①

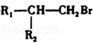 ②
②
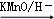

DEHP(C24H38O4)是增塑剂的一种,可通过下列流程制备,其中A的主链上有6个碳原子,D是对二甲苯的一种同分异构体,E的苯环上存在2种不同化学环境的氢原子.
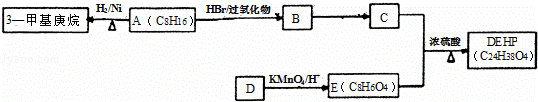
(1)3﹣甲基庚烷的某同分异构体分子中只存在1种不同化学环境的氢原子,用系统命名法命名为
(2)写出B→C的化学反应方程式,请注明反应条件和反应类型.
B→C: ;反应类型: ;
(3)E的结构简式是 ;DEHP的结构简式是 ;
(4)F是E的一种同分异构体,具有如下特征:
a.是苯的邻位二取代物; b.遇FeCl3溶液呈紫色; c.能与碳酸氢钠溶液反应.
写出F分子中官能团的名称为 ;
(5)G与E形成的混和物,只要物质的量一定,不论二者比例如何,燃烧耗氧是一定值.则满足条件的相对分子质量最小的G的分子式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
 将一定质量的镁和铝混合物投入200 mL稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入的NaOH溶液体积的变化关系如图所示。则下列说法不正确的是 ( )
将一定质量的镁和铝混合物投入200 mL稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入的NaOH溶液体积的变化关系如图所示。则下列说法不正确的是 ( )
A.镁和铝的总质量为9 g
B.最初20 mL NaOH溶液用于中和过量的稀硫酸
C.氢氧化钠溶液的物质的量浓度为5 mol·L-1
D.生成的氢气在标准状况下的体积为11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
某粗盐主要成分为氯化钠,杂质为不溶性泥沙和可溶性的MgCl2、CaCl2和Na2SO4.某校化学兴趣小组欲探究食盐的精制过程,以该粗盐为原料,设计方案流程如下:
试回答下列问题:
(1)在第①步和第⑤步中都要用到玻璃棒,它们的主要作用分别是 、 .
(2)第②步操作的目的是除去粗盐中的 (填化学式,下同),第⑥步操作的目的是除去滤液中的 、 .
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、 、 (填化学式)
(4)在第⑨步操作中,选择的除杂试剂不能用KOH代替NaOH,理由是 .写出第⑥步涉及的两个化学反应的离子方程式: 、 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com