
分析 发生反应:Cl2 +2NaBr=2NaCl+Br2,根据固体质量差利用差量法计算NaBr的质量,进而计算原混合物中NaCl质量,再计算原混合物中NaCl物质的量,最后根据物质的量浓度定义式计算.
解答 解:设混合物中NaBr的质量为m,则:
Cl2 +2NaBr=2NaCl+Br2 固体质量减小△m
206 160-71=89
m 22g-17.55g=4.45g
所以m=$\frac{4.45g×206}{89}$=10.3g
则混合物中NaCl质量为22g-10.3g=11.7g,其物质的量为$\frac{11.7g}{58.5g/mol}$=0.2mol,
则原混合物溶于水,配成100mL溶液,所得溶液中NaCl的物质的量浓度为$\frac{0.2mol}{0.1L}$=2mol/L,
答:原混合物所得溶液中NaCl的物质的量浓度为2mol/L.
点评 本题考查有关混合物反应的计算,题目难度中等,注意掌握差量法在计算出的应用,试题培养了学生的分析理解能力及计算能力.


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:选择题
| A. | 相同温度下,0.1 mol•L-1NH4Cl溶液比0.1 mol•L-1NH4HSO4溶液含有的[NH4+]更大 | |
| B. | 将0.1 mol•L-1硫酸溶液从常温加热至100℃,溶液的pH保持不变 | |
| C. | 稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ | |
| D. | 在蒸发皿中加热蒸发(低于400℃)FeCl3溶液,可以得到FeCl3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水的电子式:H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$]2-H+ | |
| B. | 乙烷的结构简式:C2H6 | |
| C. | 铝的原子结构示意图: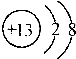 | |
| D. | 硫酸钠的电离方程式:Na2SO4═2Na++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
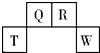 短周期元素T、Q、R、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族族序数相等.它们的最高价氧化物的水化物依次为甲、乙、丙、丁.下列叙述不正确的是( )
短周期元素T、Q、R、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族族序数相等.它们的最高价氧化物的水化物依次为甲、乙、丙、丁.下列叙述不正确的是( )| A. | R的氢化物可以既有极性键又有非极性键 | |
| B. | 常温下丁的浓溶液可用T单质所制的容器来盛装 | |
| C. | 丁的浓溶液与Q的单质加热发生反应,可生成体积比为1:2的两种气体 | |
| D. | 甲、乙、丙、丁受热均易分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧燃电池在碱性介质中负极的反应式是:O2+2H2O+4e-=4OH- | |
| B. | NaHCO3在水溶液中的水解离子方程式:HCO3-+H2O?CO2↑+OH- | |
| C. | 用FeS为沉淀剂除去废水中的Hg2+:FeS(s)+Hg2+(aq)=HgS(s)+Fe2+ (aq) | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-=Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
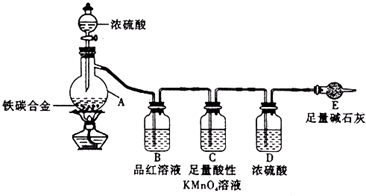
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
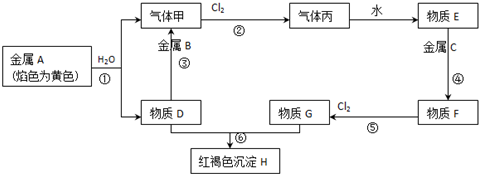
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com