
【题目】生产硫酸的主要反应:2SO2(g)+O2(g)![]() 2SO3(g)△H<0。图中L(L1、L2)、X可分别代表压强或温度。下列说法正确的是
2SO3(g)△H<0。图中L(L1、L2)、X可分别代表压强或温度。下列说法正确的是
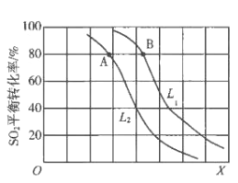
A. X代表压强
B. 推断L1>L2
C. A、B两点对应的平衡常数相同
D. 一定温度下,当混合气中n(SO2):n(O2):n(SO3)=2:1:2,则反应一定达到平衡
【答案】B
【解析】
生产硫酸的主要反应:2SO2(g)+O2(g)![]() 2SO3(g)△H<0,该反应的正反应是一个气体分子数目减少的放热反应,根据化学平衡移动原理可知,在其它条件不变时,随温度的升高,化学平衡逆向移动,二氧化硫的平衡转化率下降,故X代表温度;随着压强的增大,二氧化硫的平衡转化率增大,故图中L代表压强,且L1>L2,据此分析可得结论。
2SO3(g)△H<0,该反应的正反应是一个气体分子数目减少的放热反应,根据化学平衡移动原理可知,在其它条件不变时,随温度的升高,化学平衡逆向移动,二氧化硫的平衡转化率下降,故X代表温度;随着压强的增大,二氧化硫的平衡转化率增大,故图中L代表压强,且L1>L2,据此分析可得结论。
A.因该反应正反应是一个分子数目减少的反应,增大压强,平衡正向移动,二氧化硫的平衡转化率应增大,与图示变化不符,故A错误;
B.由上述分析可知,图中L代表压强,因该反应正反应是一个分子数目减少的反应,所以在其它条件相同时,压强越大,二氧化硫的转化率越大,则L1>L2,故B正确;
C.由上述分析可知,X代表温度,则A、B两点的温度不同,化学平衡常数不同,故C错误;
D.一定温度下,当混合气中n(SO2):n(O2):n(SO3)=2:1:2时,反应混合物中各组份的浓度不一定保持不变,不一定是平衡状态,故D错误;
答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g)![]() 2C(g)+2D(g)在四种不同情况下的反应速率如下,其中表示反应速率最快的是( )
2C(g)+2D(g)在四种不同情况下的反应速率如下,其中表示反应速率最快的是( )
A. v(A)=0.15 mol·L-1·min-1B. v(B)=0.01 mol·L-1·s-1
C. v(C)=0.40 mol·L-1·min-1D. v(D)=0.45 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘元素有多种价态,可以形成多种含氧阴离子IxOyn—。由2个IO62—正八面体共用一个面形成的IxOyn- 的化学式为( )
A.I2O94-B.I2O106-C.I2O118-D.I2O1210-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为淡黄色固体,R和T是两种生活中常见的金属单质,C、F是无色无味的气体。
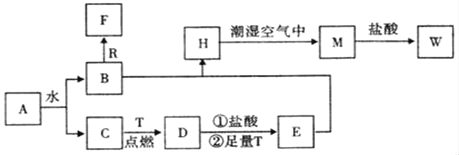
(1)物质A的化学式为_____,D化学式为_____,W的化学式为_____;
(2)B与R反应生成F的离子反应式为___________;
(3)A与CO2反应的化学反应方程式为____________;
(4)H转化为M的化学反应方程式为_____________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分, 针对表中的①~⑧种元素,填写下列空白:
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA[ | 零 |
2 | ① | ② | ③ | |||||
3 | ④[ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)上述元素中,化学性质最不活泼的是 (填元素符号)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是 (填元素符号)。
(3)元素②的气态氢化物分子属于 (填电解质或非电解质);元素⑦与④形成化合物的电子式是 。
(4)元素⑤的最高价氧化物与氢氧化钠溶液反应的离子方程式为: 。
(5)元素④的某氧化物可作供氧剂,该氧化物中所含的化学键类型有 ,写出其与二氧化碳反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化物法生产亚氯酸钠的工艺流程图:
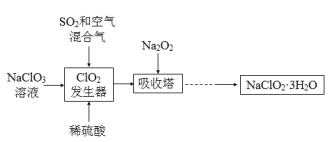
已知:
①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O;
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释至10%以下较安全;
(1)NaClO2中Cl的化合价为______。
(2)在发生器中鼓入SO2和空气混合气的原因是______ (填序号)。
A 空气稀释ClO2以防止爆炸
B SO2将NaClO3氧化成ClO2
C 稀硫酸可以增强NaClO3的氧化性
(3)Na2O2可改为H2O2和NaOH的混合溶液,吸收塔中发生的反应的化学方程式______;吸收塔的温度不能超过20oC,主要原因是______。
(4)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是______ (填序号)。
A 蒸馏 B 蒸发浓缩 C 灼烧 D 过滤 E 冷却结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将甘油(C3H8O3)转化成高附加值产品是当前热点研究方向,如甘油和水蒸气、氧气经催化重整或部分催化氧化可制得氢气,反应主要过程如下:
甘油水蒸气重整 (SPG) | C3H8O3(1)+3H2O(g) | 反应I |
甘油部分氧化 (POG) | C3H8O3(1)+ | 反应II |
甘油氧化水蒸气 重整(OSRG) | C3H8O3(1)+ | 反应III |
(1)下列说法正确的是________(填字母序号)。
a. 消耗等量的甘油,反应I的产氢率最高
b. 消耗等量的甘油,反应Ⅱ的放热最显著
c. 经过计算得到反应Ⅲ的 △H3=-237.5 kJ·mol-1
d. 理论上,通过调控甘油、水蒸气、氧气的用量比例可以实现自热重整反应,即焓变约为0,这体现了科研工作者对吸热反应和放热反应的联合应用
(2)研究人员经过反复试验,实际生产中将反应Ⅲ设定在较高温度(600~700℃)进行,选择该温度范围的原因有:催化剂活性和选择性高、__________。
(3)研究人员发现,反应I的副产物很多,主要含有:CH4、C2H4、CO、CO2、CH3CHO,CH3COOH等,为了显著提高氢气的产率,采取以下两个措施。
①首要抑制产生甲烷的副反应。从原子利用率角度分析其原因:___________。
②用CaO吸附增强制氢。如图1所示,请解释加入CaO的原因:__________。

(4)制备高效的催化剂是这种制氢方法能大规模应用于工业的重要因素。通常将Ni分散在高比表面的载体(SiC、Al2O3、CeO2)上以提高催化效率。分别用三种催化剂进行实验,持续通入原料气,在一段时间内多次取样,绘制甘油转化率与时间的关系如图2所示。
①结合图2分析Ni/SiC催化剂具有的优点是_________。
②研究发现造成催化效率随时间下降的主要原因是副反应产生的大量碳粉(积碳)包裹催化剂,通过加入微量的、可循环利用的氧化镧(La2O3)可有效减少积碳。其反应机理包括两步:
第一步为:La2O3+CO2![]() La2O/span>2CO3
La2O/span>2CO3
第二步为:__________(写出化学反应方程式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定物质的量的Cl2与NaOH溶液反应,所得产物中含NaClO和NaClO3物质的量之比为3∶5,则参加反应的Cl2与NaOH物质的量之比为( )
A. 8∶11 B. 3∶5 C. 1∶2 D. 18∶8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在由铜片和300 mL稀硫酸组成的原电池中,若锌片只发生电化学腐蚀(锌片上没有气体生成),当在铜片上放出3.36 L(标准状况)的氢气时,硫酸恰好用完,则:
(1)产生这些气体消耗锌的质量是多少?______
(2)通过导线的电子的物质的量是多少?______
(3)原稀硫酸的物质的量浓度是多少?______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com