
A、B、C、D、E为五种元素的单质,其余为化合物。其中只有E为金属元素,五种元素的原子序数按B、D、C、A、E顺序依次增大,D、C元素在周期表中位置相邻,在一定条件下,B分别和A、C、D化合生成甲、乙、丙,乙、丙每个分子中均含有10个电子;C和D化合可得丁。各物质相互转化关系如下图:
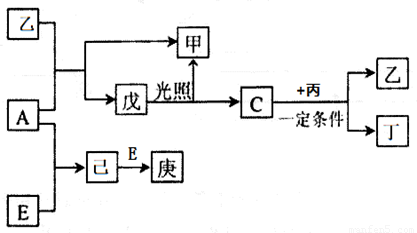
请回答下列问题:
(1)写出E元素在周期表的位置 。
(2)戊的名称为_________________;用途 (只写一种)。
(3)写出实验室制取A反应的离子方程式_________________________________。
(4)常温下A与足量的丙发生反应生成单质D,写出该反应的化学方程式
____________________________________________________________________。
(5)写出足量E和稀硝酸反应的化学方程式:
_______________________________________________________________________。
(6)实验室配制庚溶液的方法是______________________________________________。
(1)第四周期第Ⅷ族 (2分)
(2)次氯酸 (1分)做漂白剂 (其他合理均给分)(1分)
(3)MnO2 + 4H+ + 2Cl― Mn2+ + Cl2↑
+ 2H2O (2分)
Mn2+ + Cl2↑
+ 2H2O (2分)
(4)3Cl2+8NH3=N2+6NH4Cl (3分)
(5)3Fe +8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O (3分)
(6)向盐酸中加入适量的FeCl2晶体,(1分)然后加水稀释,并加入少许铁粉。(1分)
【解析】
试题分析:已知B分别和A、C、D化合生成甲、乙、丙,乙、丙每个分子中均含有10个电子,又知B原子序数最小,推测B为H元素,戊光照分解得到甲和C,则戊是HClO。
(1)E为Fe,位于第四周期第Ⅷ族
(2)戊为HClO,可做漂白剂。
(3)实验室制备氯气,注意离子方程式的书写。
(4)氯气可以氧化氨气,得到氮气。
(5)铁和稀硝酸反应,得到一氧化氮。
(6)制备FeCl2溶液,需要考虑防止亚铁离子的水解和防氧化。
考点:本题考查了元素的推断,涉及到了10电子微粒,实验室制备,化学方程式的书写的知识,推导过程有一定的难度。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 A、B、C、D、E为中学化学常见物质,其中A、C为金属单质,E为非金属单质,下图是它们之间的相互转化关系.请回答:
A、B、C、D、E为中学化学常见物质,其中A、C为金属单质,E为非金属单质,下图是它们之间的相互转化关系.请回答:
| ||
| ||
| Cu |
| Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解




查看答案和解析>>
科目:高中化学 来源: 题型:
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com