
【题目】下列分子为手性分子的是
A. CH2Cl2B. ![]()
C. ![]() D. CH3CH2COOCH2CH3
D. CH3CH2COOCH2CH3
【答案】B
【解析】
手性碳原子指连有四个不同基团的碳原子,判断手性碳原子时要注意:
(1)手性碳原子一定是饱和碳原子;
(2)手性碳原子所连接的四个基团一定是不同的,然后根据手性分子是含有手性碳原子的分子。
A.CH2Cl2碳原子所连接的4个基团分别为2个H原子、2个Cl原子,没有手性碳原子,所以不属于手性分子,选项A错误;
B.![]() 中间的碳原子连接四个不同取代基,该碳原子具有手性,所以该有机物属于手性分子,选项B正确;
中间的碳原子连接四个不同取代基,该碳原子具有手性,所以该有机物属于手性分子,选项B正确;
C.![]() 中一个碳原子为不饱和碳原子,没有手性碳原子,不属于手性分子,选项C错误;
中一个碳原子为不饱和碳原子,没有手性碳原子,不属于手性分子,选项C错误;
D.CH3CH2COOCH2CH3中一个中间碳原子为不饱和碳原子,另四个碳原子所连接的四个基团有相同的,没有手性碳原子,不属于手性分子,选项D错误。
答案选B。


科目:高中化学 来源: 题型:
【题目】在接触法制硫酸和合成氨工业的生产过程中,下列说法错误的是()
A.硫铁矿在燃烧前要粉碎,目的是使硫铁矿充分燃烧,加快反应速率
B.二氧化硫的催化氧化反应的温度控制在450度左右,主要考虑到催化剂V2O5的活性温度
C.吸收塔中用98.3%的浓硫酸代替水吸收SO3,以提高效率
D.工业上为提高反应物N2、H2的转化率和NH3的产量和反应速率,常在合成氨反应达到平衡后再分离氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在普通铝中加入少量Cu和Mg后,形成一种称为拉维斯相的MgCu2微小晶粒,其分散在Al中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要村料。回答下列问题:
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是______________。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是_________、_________。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其中与乙二胺形成的化合物稳定性相对较高的是____________(填“Mg2+”或“Cu2+”)。
(3)一些氧化物的熔点如表所示:
氧化物 | Li2O | MgO | P4O6 | SO2 |
熔点/°C | 1570 | 2800 | 23.8 | 75.5 |
解释MgO熔点比P4O6熔点高得多的原因______________
(4)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)
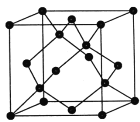
①碳化硅晶体(金刚砂)的化学式______________
②金刚石、晶体硅、碳化硅的熔点由高到低的顺序为__________________
③立方氮化硼晶体的结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5 pm。立方氮化硼的密度是_____________g/cm3(列出式子并化简,阿伏加德罗常数为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是一种常见化学电源,其原理反应:2H2+O2=2H2O,其工作示意图如图。下列说法不正确的是( )
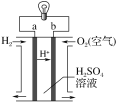
A.a极是负极,发生反应为H2-2e-=2H+
B.b电极上发生还原反应,电极反应式为O2+4H++4e-=2H2O
C.电解质溶液中H+向正极移动
D.放电前后电解质溶液的pH不会发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:将Cl2通入适量NaOH溶液,产物中可能有NaCl、NaClO、NaClO3,且![]() 的值仅与温度高低有关,当n(NaOH)=6a mol时,下列有关说法正确的是
的值仅与温度高低有关,当n(NaOH)=6a mol时,下列有关说法正确的是
A. 改变温度,反应中转移电子的物质的量n的范围:3a mol≤n≤5a mol
B. 改变温度,产物中NaCl的最小理论产量为4a mol
C. 参加反应的氯气的物质的量为6a mol
D. 某温度下,若反应后![]() =6,则溶液中
=6,则溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H+可以写成H3O+,从某些性质看,NH3和H2O,![]() 和H3O+,OH-和
和H3O+,OH-和![]() ,N3-和O2-两两相似,据此判断下列反应式(反应条件忽略)正确的是( )
,N3-和O2-两两相似,据此判断下列反应式(反应条件忽略)正确的是( )
①2Na+2NH3=2NaNH2+H2↑
②CaO+2NH4Cl=CaCl2+2NH3↑+H2O
③3Mg(NH2)2=Mg3N2+4NH3↑
④NH4Cl+NaNH2=NaCl+2NH3↑
A.①B.②④C.全部D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究苯与溴的取代反应,甲用下图装置Ⅰ进行如下实验:
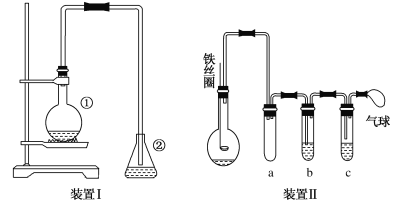
将一定量的苯和溴放在烧瓶中,同时加入少量铁屑作催化剂,3~5分钟后发现滴有AgNO3的锥形瓶中有浅黄色的沉淀生成,即证明苯与溴发生了取代反应。
(1)装置Ⅰ中①的化学方程式为__________________________。
(2)烧瓶中生成的红褐色油状液滴的成分是溴苯和溴单质,要想得到纯净的产物,可用NaOH溶液试剂洗涤。洗涤后分离粗产品应使用的仪器是________________。
(3)乙同学设计上图所示装置Ⅱ,并用下列某些试剂完成该实验。可选用的试剂是:苯;液溴;浓硫酸;氢氧化钠溶液;硝酸银溶液;四氯化碳。
a的作用是__________________。b中的试剂是___________________。比较两套装置,装置Ⅱ的主要优点__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室制氨气的装置图,请回答:
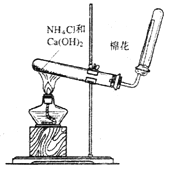
(1)收集氨气用__法;
(2)实验室制取氨气的化学反应方程式:__;
(3)干燥氨气可选用__;
(4)如何检验氨气是否收集满:__;
(5)实验装置中棉花的作用是:__;
(6)制取出来的氨气可以遇到一种挥发出来的气体冒出大量白烟,且产生晶体,写出化学反应方程式__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com