
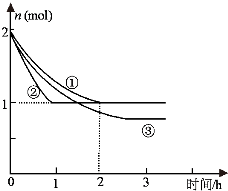
 合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-94.2kJ?mol-1,分别在反应条件不同,但体积均为2L的三个固定体积的容器中反应,起始时N2、H2和NH3的物质的量分别为2mol、6mol、0mol,N2的物质的量随时间的变化如图所示.
合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-94.2kJ?mol-1,分别在反应条件不同,但体积均为2L的三个固定体积的容器中反应,起始时N2、H2和NH3的物质的量分别为2mol、6mol、0mol,N2的物质的量随时间的变化如图所示.
| 各个生成物平衡浓度系数次方的乘积 |
| 各个反应物平衡浓度系数次方的乘积 |
| △c |
| △t |
| c(NH3)2 |
| c(N2)?c(H2)3 |
| 1.02 |
| 0.5×1.53 |
| 16 |
| 27 |
| 1.5mol/L |
| 2h |
| 16 |
| 27 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
+ 2 |
- 6 |
+ 2 |
- 6 |
+ 4 |
| 10-9 |
| a-0.01 |
| 10-9 |
| a-0.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:
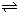 =PtF6-(g)△H2=-771.1kJ?mol-1
=PtF6-(g)△H2=-771.1kJ?mol-1| 10-9 |
| a-0.01 |
| 10-9 |
| a-0.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(H2)=0.1mol/(L?s) | B、v(N2)=0.1mol/(L?s) | C、v(N2)=0.2mol/(L?s) | D、v(NH3)=0.3mol/(L?s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、对于△S>0的反应,若在任何温度下均能自发进行,则该反应△H>0 | B、氢氧燃料电池发电,比氢气直接在空气中燃烧发电能量转换率高 | C、合成氨反应N2(g)+3H2(g)?2NH3(g)△H<0,加入催化剂能加快反应速率并提高转化率 | D、25℃Ksp[Al(OH)3]=2×10-33,Ksp(AlPO4)=1.310-20,在各自的饱和溶液中,c(Al3+)前者小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com