
分析 (1)若平衡体系的pH=2,溶液呈酸性,氢离子浓度变大,平衡2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O正向移动,所以溶液呈橙色;
(2)当V正=V逆,或各组分的浓度保持不变则说明已达平衡,
a、两者浓度应不变,而不是相等;
b、速率未体现正与逆的关系;
c、气体颜色不变,说明有色气体的浓度不变;
(3)写出第②步反应的离子方程式为Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O,在氧化还原反应中得失电子守恒,据此分析计算;
(4)根据溶度积常数以及水的离子积常数来进行计算.
解答 解:(1)若平衡体系的pH=2,溶液呈酸性,氢离子浓度变大,平衡2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O正向移动,所以溶液呈橙色,故答案为:橙色;
(2)a、两者浓度应不变,而不是相等,故错误;
b、速率未体现正与逆的关系,故错误;
c、平衡时各物质的浓度不再改变,即溶液的颜色不再改变,故正确;
故答案为:c;
(3)写出第②步反应的离子方程式为Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O,根据电子得失守恒:n(Cr2O72-)×6=n(FeSO4•7H2O)×1,n(FeSO4•7H2O)=$\frac{1×6}{1}$=6mol,质量的量为6mol,故答案为:Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O;6;
(4)当c(Cr3+)=10-5mol/L时,溶液的c(OH-)=$\root{3}{\frac{1{0}^{-32}}{1{0}^{-5}}}$=10-9 mol/L,c(H+)═$\frac{1{0}^{-14}}{1{0}^{-9}}$=10-5mol/L,pH=5,即要使c(Cr3+)降至10-5mol/L,溶液的pH应调至5,故答案为:5.
点评 本题主要考查了化学平衡移动原理、氧化还原反应、沉淀溶解平衡等内容.解题根据题给信息,再结合相关原理可进行解答.


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中三个碳原子可能处于同一直线上 | |
| B. | 全氟丙烷的电子式为: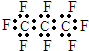 | |
| C. | 相同压强下,沸点:C3F8<C3H8 | |
| D. | 一个全氟丙烷分子中有10个共用电子对 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 杂质 | 试剂 | 主要操作 | |
| A | NaHC03固体 | Na2C03固体 | / | 加热 |
| B | Al2O3 | Fe2O3 | 盐酸 | 过滤 |
| C | KBr溶液 | Br2 | KOH溶液 | 分液 |
| D | Cl2 | HCl | 饱和食盐水 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 序号 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
| ① | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
| ② | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
| ③ | 双氧水的浓度对破氰反应速率的影响 | 7 | 60 | 10 | 20 | 10 |

| 实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醇和酚不能是同分异构体 | |
| B. | 醇和酚都能与钠发生反应,放出氢气 | |
| C. | 醇、酚的水溶液都能使石蕊试纸变红 | |
| D. | 醇和酚都能与氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该硫酸的物质的量浓度为1.84mol/L | |
| B. | 稀释该硫酸时,应将蒸馏水沿玻璃棒缓慢注入其中 | |
| C. | 配制200mL4.6mol•L-1的稀硫酸需取该硫酸50.0mL | |
| D. | 常温下,5.6gFe与足量的稀硫酸反应转移电子的物质的量为0.3mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com