
I.��֪������������ԭ��Ӧ��Zn+2HNO3+NH4NO3��N2��+Zn(NO3)2+3H2O����
��1���÷�Ӧ�Ļ�ԭ��Ϊ������������������ԭ����Ϊ������������������д��ѧʽ��
��2����������N2�ڱ�״�������Ϊ2.24L����Ӧ��ת�Ƶĵ�����Ϊ��������NA��
II.��6�֣���ѧ�����ǵ�����������أ����û�ѧ����ʽ�������������е�ʵ����
��1��ʢ��NaHCO3�ĸɷ�������������
��2�����ʲ˵��ġ���𡱹��գ������ȵIJ˵�����ˮ�м�����ȴ
��3�����������õ�����ˮ���뾭��̫����ɹ�����ʹ��
I.(6��)��1��Zn��NH4NO3�����֣�������N2�����֣����� ����2��0.5��2�֣�
II.��6�֣�
��1��2NaHCO3 Na2CO3��CO2����H2O
Na2CO3��CO2����H2O
(2)3Fe��4H2O  Fe3O4��4H2 (3)2HClO
Fe3O4��4H2 (3)2HClO 2HCl��O2�� ��ÿ��2�֣�
2HCl��O2�� ��ÿ��2�֣�
��������
���������I. ��1��Zn��NH4NO3��NH4+�е�NԪ�أ����ϼ����ߣ��Ƿ�Ӧ�Ļ�ԭ����N2���������������ǻ�ԭ���
��2��2.24L��0.1mol����Ӧ��ת�Ƶĵ�����Ϊ0.5NA��
II. ��1������NaHCO3�����ֽ�������CO2��ԭ��������ʽΪ2NaHCO3 Na2CO3��CO2����H2O��
Na2CO3��CO2����H2O��
��2������Fe�ڸ�����������ˮ������Ӧ��ԭ��������ʽΪ3Fe��4H2O  Fe3O4��4H2��
Fe3O4��4H2��
��3����������������ˮ�к���HClO����HClO����ǿ�����Ե������ֽ⣬��ɹ�����ʹ�ã�����ʽΪ2HClO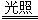 2HCl��O2����
2HCl��O2����
���㣺������ԭ��Ӧ��Ӧ�� ��ѧ������
���������⿼��������ԭ��Ӧ��Ӧ�úͻ�ѧ����������֪ʶ��Ҫ��ѧ�����з����ͽ��������������Ѷ��еȡ�


 ��У��������ĩ��̾�ϵ�д�
��У��������ĩ��̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| n(ClO-) | n(ClO3-) |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
| �� |



| ���� |
| ���� |
| Cu��Ag |
| �� |
| Cu��Ag |
| �� |

| Ũ���� |
| �� |
| Ũ���� |
| �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
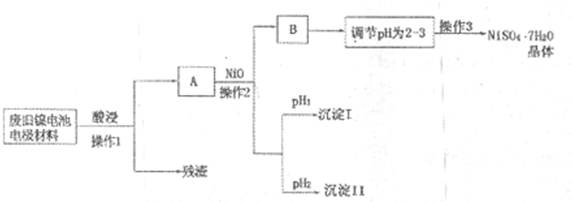
| M��OH��n | Ksp | pH | |
| ��ʼ���� | ������ȫ | ||
| Al��OH��3 | 1.9��10-23 | 3.43 | 4.19 |
| Fe��OH��3 | 3.8��10-38 | 2.53 | 2.94 |
| Ni��OH��2 | 1.6��10-14 | 7.60 | 9.75 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
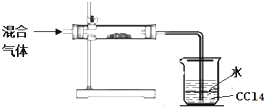
| ʵ�鷽�� | ���ܵ��������Ӧ�Ľ��� |
| ȡ�����ձ��е��ϲ���Һ��װ��A��B��֧�Թ��� | |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com